Начнём с цитаты известного советского химика и инженера, академика Георгия Константиновича Борескова:
«Если бы на Земле вдруг исчезли все катализаторы, наша планета скоро стала бы безжизненной пустыней, омываемой океаном слабой азотной кислоты».
Неуютная картина, не правда ли? Поэтому сегодняшняя наша цель – разобраться, почему же Земля всё-таки выглядит более привычно для нашего глаза.
Из уроков химии вам должно быть известно, что такое катализ. Давайте вспомним. Катализом называется явление ускорения реакции без изменения её общего результата. Термин «катализ» был введён в 1835 году шведским учёным Йёнсом Якобом Берцелиусом.

Для протекания многих химических реакций необходимы специальные условия. Чаще всего на скорость реакций влияют температура и давление. Чем они выше, тем быстрее протекает химическая реакция. Но её скорость можно увеличить, не изменяя внешних условий, а просто добавив к реагирующей смеси определённые вещества. Так, металлический родий почти в 10000 раз ускоряет разложение муравьиной кислоты на углекислый газ и водород. Такие вещества, увеличивающие скорость реакции, но не входящие в состав продуктов реакции, называются катализаторами.
В
клетках живых организмов каждую секунду происходят тысячи химических реакций.
И это несмотря на то, что в живой клетке умеренная температура и нормальное
давление. Например, бактерии из рода Азотобактер могут при обычных условиях
разрывать прочнейшую молекулу азота, где атомы соединены тремя ковалентными
связями и присоединять их к водороду. А для того, чтобы проделать то же самое
человеку в промышленности, необходимо создать давление в 350 раз большее, чем
на поверхности Земли и поднять температуру до 500 градусов Цельсия.
Естественно, бактерии не обходятся при этом без катализаторов. Кстати, люди
также пытались применить их при получении аммиака. Перепробовав при этом более
20000 различных веществ.
Что же за всесильные вещества – эти катализаторы?
Катализаторами
химических реакций в неживой природе могут быть самые различные вещества. Это и
уже упомянутый нами экзотический родий, который используется для изготовления
зеркал супермощных лазеров и обычный оксид марганца, применяемый для получения
кислорода даже в школьной лаборатории.
Кроме того, неорганические катализаторы могут ускорять реакции с разными
веществами. Например, родий не только эффективно разлагает муравьиную кислоту,
но и борется с выбросами вредных оксидов азота в автомобильных катализаторах.
Другое
дело – биологические, а значит, органические катализаторы. На них мы
остановимся более подробно.
Многочисленные исследования прошлого нашей планеты говорят о том, что на
начальном этапе зарождения жизни каталитической способностью обладали некоторые
молекулы рибонуклеиновых кислот.

И тогда это свойство РНК имело очень важное значение. Сегодня же роль молекул РНК как катализаторов крайне мала. А основными биокатализаторами в клетке являются ферменты. Которых уже к 2013 году было описано более пяти тысяч видов.
Термин фермент (от латинского fermentum – «брожение», «закваска») был предложен в XVII веке химиком ван Гельмонтом при обсуждении механизмов пищеварения.
Абсолютно все процессы в живом организме прямо или косвенно осуществляются с участием ферментов или энзимов, как их ещё называют. Это и фиксация углерода в процессе фотосинтеза, и расщепление питательных веществ в пищеварительном тракте, и синтез источника энергии для всех живых организмов – АТФ, и многое –многое другое.
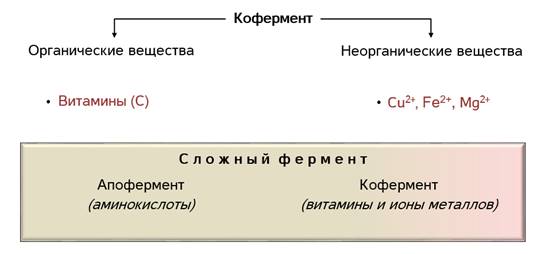
Как вы помните, по химической природе биологические катализаторы относятся к белкам. Они могут быть как простыми, состоящими только из аминокислот, так и сложными, включающими белок и небелковую часть – простетическую группу. Простетическая группа фермента называется кофермент, а белковая часть – апофермент.
В роли коферментов выступают органические и неорганические вещества. Среди органических это могут быть витамины, например, аскорбиновая кислота. А из неорганических – ионы различных металлов. Например, ионы меди, железа, магния.
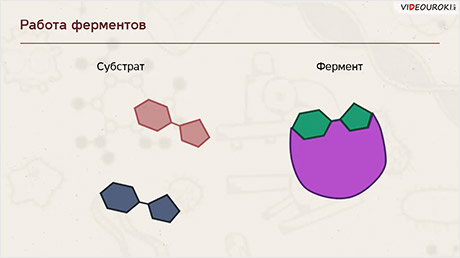
Ферменты ускоряют химические реакции за счёт тесного взаимодействия с молекулами исходных реагирующих веществ – так называемых субстратов. Зачастую размеры молекул субстратов значительно меньше размеров молекул самих ферментов, хотя, казалось бы, должно быть наоборот. Поэтому с субстратом или субстратами, потому что их может быть несколько, взаимодействует не вся молекула фермента, а лишь небольшой её участок – активный центр фермента. Построен он чаще всего из нескольких аминокислотных остатков, которые образуют его уникальную структуру. Почему уникальную? Дело в том, что форма и химическое строение активного центра таковы, что с ним могут связываться только те субстраты, структура которых подходит к структуре активного центра.
Магия этого процесса неизвестна до сих пор. Несмотря на то, что человечество в ближайшее время планирует полёты на Марс, оно не в состоянии разобраться со своим организмом. Но существует теория. Её выдвинул ещё в 1890 году немецкий химик Эмиль Фишер.
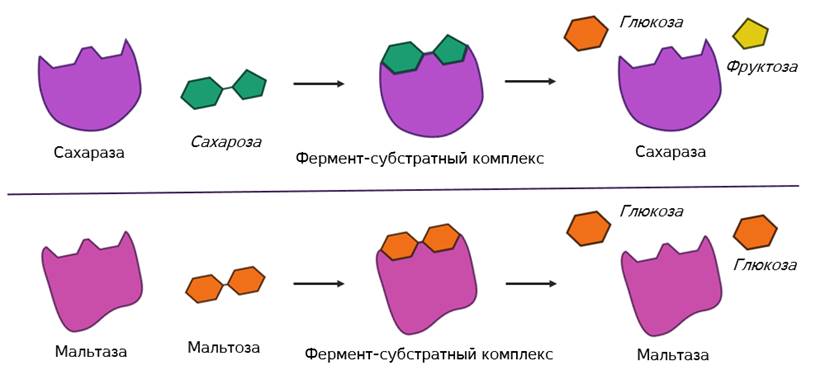
Называется его предположение моделью «ключ-замок». То есть, субстрат по своему строению подходит к активному центру, как ключ к замку с образованием короткоживущего фермент-субстратного комплекса.
В
этом комплексе молекула субстрата деформируется и в её структуре ослабляются
определённые химические связи. Что приводит к облегчённому их разрыву и в
конечном итоге к ускорению химической реакции.
После этого фермент-субстратный комплекс распадается на
конечные продукты и свободный фермент, а активный центр последнего тут же готов
принимать новые молекулы субстрата. Получаем такой же итог, как и в случае
работы обычных химических катализаторов – скорость реакции увеличивается, а сам
катализатор при этом не расходуется и может использоваться многократно.
Но в самом механизме работы органических и неорганических катализаторов есть кардинальное отличие. Каждый фермент действует только на определённый тип связи и ускоряет только одну определённую реакцию. То есть обладает специфичностью. Как вы поняли, специфичность объясняется соответствием активного центра только определённым субстратам. Поэтому, например, фермент мальтаза, разлагающий дисахарид мальтозу до двух молекул глюкозы оказывается не способным разрушать молекулы сахарозы. Несмотря на то, что сахароза также является дисахаридом.
Наверное,
именно благодаря специфичности, биологические катализаторы работают на несколько
порядков быстрее,
по сравнению со своими неорганическими коллегами. Они ускоряют химические
реакции в миллионы и миллиарды раз! Против ускорения в сотни и тысячи
раз для обычных катализаторов. Например, одна молекула каталазы за одну
секунду способна расщепить 44000 молекул перекиси водорода. Причём, делает она это при нормальном давлении и
умеренной температуре.
Но за высокую скорость работы всегда нужно чем-то расплачиваться. Белковая
природа ферментов накладывает на них жёсткие ограничения. Как вы помните,
структуры белковых молекул могут существовать только при определённых условиях
с минимальными от них отклонениями. А так как модель «ключ-замок» основана
именно на соответствии структур субстрата и активного центра фермента, то
малейшее нарушение строения биологического катализатора приводит к
невозможности его связывания с субстратом. Ферменты могут выполнять свои
функции только при определённой температуре, определённом диапазоне рН и
других факторов. Например, ферменты слюны амилаза и мальтаза
разрушают углеводы пищи в слабощелочной среде, а пепсин желудка расщепляет
белки уже в кислой. Если повышение температуры ускоряет скорость протекания
реакций с неорганическими катализаторами, то ферментативные реакции при
значительном повышении температуры замедляются и прекращаются. Именно поэтому
температура нашего тела выше 40 градусов оказывается несовместима с жизнью.
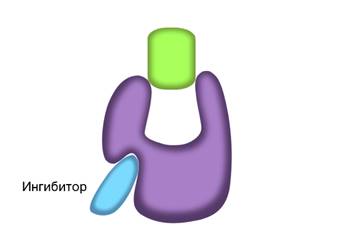
Скорость работы ферментов зависит не только от температуры. Некоторые биологические катализаторы, кроме активного центра, имеют и несколько регуляторных центров. С ними также могут связываться определённые вещества и оказывать влияние на активность фермента. Все их можно разделить на две группы. Активаторы – вещества, повышающие скорость ферментативных реакций. От латинского activus — «активный, деятельный». И ингибиторы – вещества, снижающие или блокирующие активность ферментов. От латинского inhibere — «задерживаю, останавливаю».
Активирующее
влияние на скорость ферментативной реакции оказывают разнообразные вещества
органической и неорганической природы. Например, в желудке человека соляная
кислота активирует фермент пепсин. Максимальная активность которого лежит в
пределах рН от полутора до двух.
Ингибирование ферментов может быть обратимым и необратимым. Если
вещество-ингибитор вызывает стойкое изменение пространственной структуры
фермента, то такое ингибирование будет необратимым.
А вот обратимое ингибирование, в свою очередь, бывает двух типов. Давайте их
рассмотрим.
С активным центром фермента могут связываться вещества, сходные по структуре с субстратом. Никакой реакции при этом нет, но между ингибиторами и субстратом происходит конкуренция за активный центр. Поэтому такой тип ингибирования называется конкурентным.
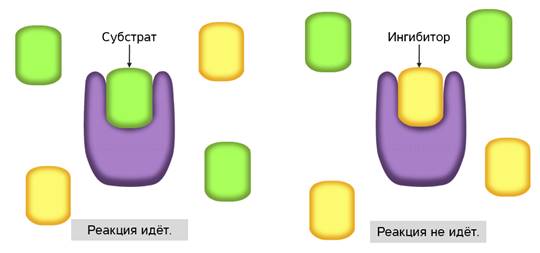
Конкурентное ингибирование широко используется в медицине. Антибиотики, противоопухолевые препараты, используемые в качестве лекарственных средств, являются конкурентными ингибиторами.
В неконкурентном ингибировании не участвуют вещества, сходные с субстратом. При таком типе ингибирования, молекулы ингибиторов присоединяются к регуляторному центру фермента. Это вызывает изменение пространственной структуры активного центра, что препятствует присоединению к нему молекул субстрата. Тем самым снижается скорость ферментативной реакции.
Уникальные
способности ферментов уже много лет используются человеком в хозяйственной
деятельности. В настоящее время развивается новая отрасль науки – промышленная
энзимология. Которая, в свою очередь, является основой биотехнологии.
Мы уже упоминали об использовании ферментов в медицине. Фармацевтическая
промышленность научилась производить искусственный аналог гормона надпочечников
кортизола – преднизолон. Который используется при лечении ревматоидного
артрита.
Широкое применение ферменты-энзимы находят также в пищевой промышленности.
Их применяют в производстве сыров, соков, овощных и фруктовых пюре. Не
обходится без применения ферментов хлебопечение, производство алкогольных напитков.
Для улучшения вкуса, аромата и консистенции их применяют для обработки мяса.
В текстильной и кожевенной промышленности ферменты позволяют значительно
увеличить выход овчины, а обработка кожи перед дублением делает её поверхность
чистой, гладкой и тонкой.
Перспективным является применение ферментов, разлагающих целлюлозу. В
результате этого из древесины, торфа, сельскохозяйственных и городских отходов
можно получить ценные биотехнологические продукты: глюкозу, этанол, ацетон и
другие. Особую актуальность это имеет в наши дни, когда проблема загрязнения
окружающей среды выходит на передний план.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 12317
12317

