Прежде, чем изучать свойства оснований, давайте с вами вспомним классификацию оснований по нескольким признакам.
Классификация оснований
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
В зависимости от степени электролитической диссоциации различают сильные основания, к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH3 · H2O).
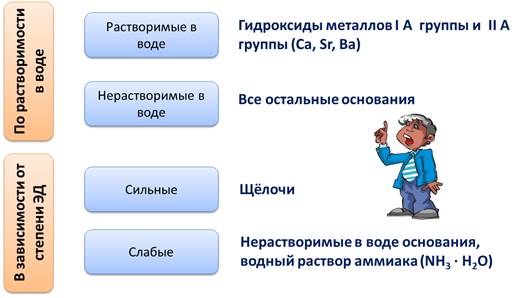
По числу гидроксогрупп основания делятся на однокислотные, у которых одна группа ОН-, например, NaOH, KOH, LiOH. Двукислотные, у которых две группы ОН-, например, Ca(OH)2, Mg(OH)2, Cu(OH)2.
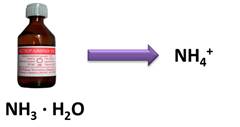
Все основания по агрегатному состоянию являются твёрдыми веществами, имеющими различную окраску. Исключение составляет только раствор аммиака в воде, представляющий собой всем известный нашатырный спирт. Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH4+) и существует только в растворе. Он легко разлагается на аммиак и воду.
NH3 · H2O ↔ NH3↑ + H2O
Такое основание, как гидроксид кальция (Са(ОН)2) имеет белую окраску, Cu(OH)2 – голубую окраску, Ni(OH)2 – зелёную окраску, а Fe(OH)3 – красно-бурую окраску.

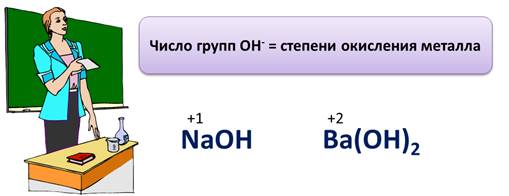
Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
Наличие группы ОН обуславливает ряд общих свойств оснований: мыльность на ощупь, изменение окраски индикаторов и др.
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.

Диссоциация оснований
NaOH = Na+ + OH-
Основания вступают в реакцию с кислотами. Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.

NaOH + HCl = NaCl + H2O
ОН- + Н+ = Н2О
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).
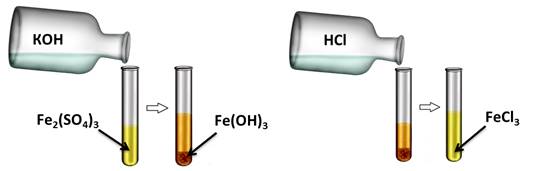
Fe2(SO4)3 + 6КOH = 2Fe(OH)3↓ + 3К2SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
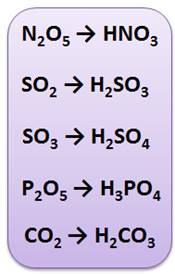
Щёлочи реагируют и с оксидами неметаллов. Каждому оксиду неметалла соответствует своя кислота, так оксиду азота (V) соответствует азотная кислота (N2O5 → HNO3), оксиду серы (IV) – сернистая кислота (SO2 → H2SO3), оксиду серы (VI) соответствует серная кислота (SO3 → H2SO4), оксиду фосфора (V) – фосфорная кислота (P2O5 → H3PO4), оксиду углерода (IV) – угольная кислота (CO2 → H2CO3) и т.д.
Поэтому в реакциях щелочей с оксидами неметаллов образуются соли соответствующих кислот и вода. Вспомните качественную реакцию на углекислый газ: известковая вода реагирует с углекислым газом, в результате чего происходит помутнение известковой воды, вследствие образования карбоната кальция.

Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са2+ + 2ОН- + СО2 = СаСО3↓ + Н2О
Эта реакция относится к реакциям обмена.
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
Проведём эксперимент, для этого нальём в первую пробирку гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата железа (III), а в третью – гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В результате появляется резкий запах аммиака. Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло. Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия: образуется осадок или слабый электролит.

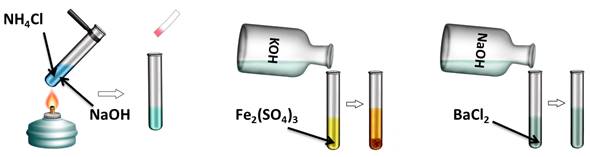
NaOH + NH4Cl = NaCl + NH3↑ + H2O
OH- + NH4+ = NH3↑ + H2O
6KOH + Fe2(SO4)3 = 3K2SO4 + 2Fe(OH)3↓
6OH- + 2Fe3+ = 2Fe(OH)3↓
NaOH + BaCl2 ≠
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Например, гидроксид железа (II) разлагается на оксид железа (II) и воду.
Fe(OH)2 = FeO + H2O
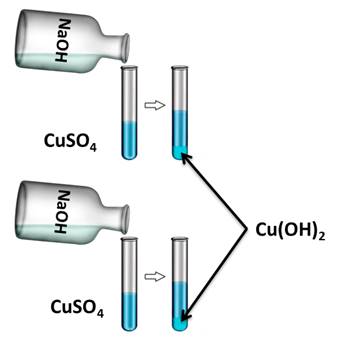
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
Cu2+ + 2OH- = Cu(OH)2↓
Если в одну из пробирок с осадком гидроксида меди (II) добавить раствора соляной кислоты, то осадок растворяется. В результате образуется соль и вода. В этом можно убедиться, если несколько капель раствора капнуть на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
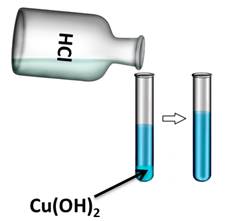
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.

Cu(OH)2 = CuO + H2O

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 13388
13388

