Периодический закон является основой современной химии и всего естествознания. Он был открыт Дмитрием Ивановичем Менделеевым 1 марта 1869 года. Дмитрий Иванович Менделеев — великий русский учёный, один из основоположников современной химии, создатель Периодической системы элементов.

Он также является создателем учебника «Основы химии», в котором вся неорганическая химия изложена на основе Периодического закона. Менделеев является автором химической теории растворов.
В 1955 году группа американских учёных во главе с Гленом Сиборгом получила новый 101 элемент, которому присвоено название «менделевий» в честь выдающегося русского учёного.

Периодическая система является графическим выражением периодического закона. Д.И. Менделеев изначально расположил все химические элементы в ряд по увеличению их атомных масс и отметил там отрезки, в которых свойства элементов и их соединений изменялись сходным образом.

На основании этого, им была предложена следующая формулировка закона: свойства химических элементов и образованных ими веществ, находятся в периодической зависимости от их относительных атомных масс.
Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
На развитие периодического закона оказала влияние не только теория строения атома, но и открытие явления существования изотопов, а также закон Мозли.
Согласно этому закону, заряд ядра атома каждого элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего элемента. Поэтому заряд атомного ядра совпадает с порядковым номером элемента в таблице Менделеева. Закон Мозли вскрыл истинный принцип, по которому Менделеев интуитивно расположил химические элементы.

Согласно теории строения атома, его главной характеристикой является положительный заряд ядра. Заряд ядра определяет положение атома в Периодической системе, число электронов в атоме, его электронное строение и все свойства атомов.
Таким образом, современная формулировка периодического закона звучит следующим образом: свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от зарядов атомных ядер.
Все химические элементы в Периодической системе расположены в порядке возрастания атомного, или порядкового номера. В каждой ячейке этой Периодической таблицы расположен химический элемент, где есть его название, порядковый номер и относительная атомная масса.
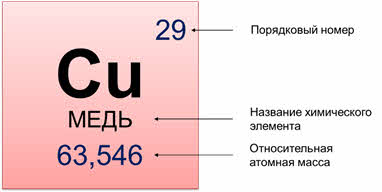
Численная величина атомного номера равна положительному заряду ядра атома соответствующего химического элемента. Кроме этого, порядковый номер указывает число протонов в нём и число электронов. Например, заряд ядра атома водорода равен плюс один, значит в атоме содержится один протон и один электрон.

Количество нейтронов в атоме можно найти по разности между массовым числом и количеством протонов.
Например, для изотопа фосфора тридцать один число нейтронов равно шестнадцати (тридцать один минус пятнадцать).
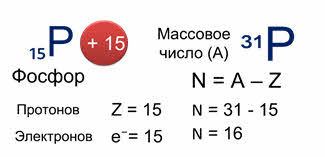
В Периодической системе химических элементов Д.И. Менделеева семь горизонтальных рядов, которые называются периодами и восемь вертикальных столбов, которые называются группами. Поэтому каждый химический элемент имеет свой порядковый номер, находится в определенном периоде и в определённой группе.

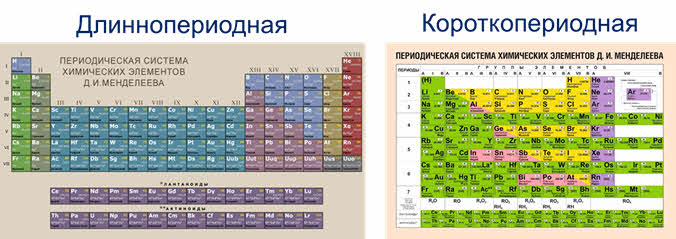
Известно около семи сот форм графического изображения периодической системы. Но их объединяет то, что элементы в них располагаются в порядке возрастания их атомных ядер. Существует два основных варианта представления периодической системы: длиннопериодный, в котором выделяют 18 групп и короткопериодный, в котором групп 8, но вводится понятие главной и побочной подгрупп.
По мере увеличения атомного номера происходит постепенное заполнение электронами соответствующих орбиталей. Таким образом, структура Периодической системы связана с электронной структурой атомов элементов.
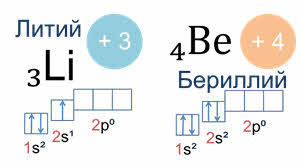
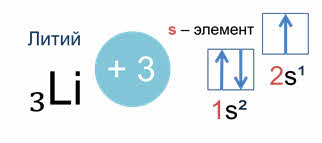
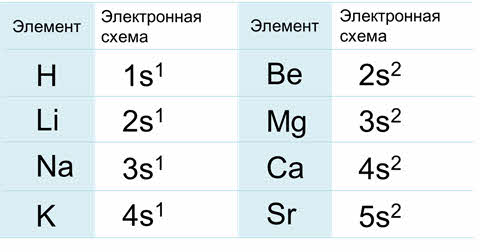
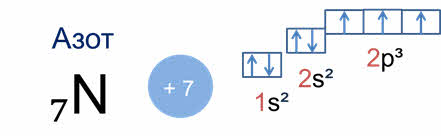
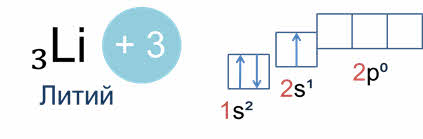
В зависимости от того, какой энергетический подуровень заполняется последним, различают четыре семейства элементов: это эс-элементы, у которых последним заполняется эс-подуровень внешнего энергетического уровня, как например, у лития, поэтому литий – эс-элемент.
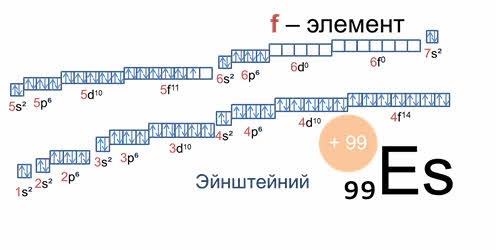
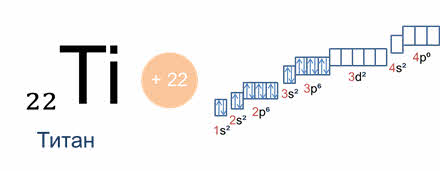
У элементов пэ-семейства последним заполняется пэ-подуровень, как, например, у фосфора, поэтому фосфор – пэ-элемент, у дэ-элементов последним заполняется дэ-подуровень, как у титана, поэтому титан – дэ-элемент, а у элементов эф-семейства последним заполняется эф-подуровень, как у эйнштэйния, поэтому эйнштэйний является эф-элементом.
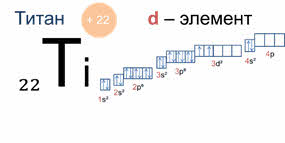
Периодом называют последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от эн-эс-один до эн-эс-два эн-пэ-шесть (кроме первого периода).
Номер периода совпадает с номером внешнего энергетического уровня. Поэтому физический смысл номера периода заключается в том, что он указывает число энергетических уровней, на которых находятся электроны в атомах данного элемента.
Малыми считаются с первого по третий период, а большими – с четвёртого по восьмой.
В первом периоде два элемента, во втором и третьем – по восемь элементов, в четвёртом и пятом – по восемнадцать элементов, в шестом и седьмом – по тридцать два элемента.
Каждый период начинается щелочным металлом и заканчивается благородным газом. Первые три периода содержат только эс- и пэ-элементы. Четвёртый, пятый и последующие периоды включают элементы, у которых происходит заполнение дэ-подуровня внешнего энергетического уровня. У элементов шестого и седьмого периодов, кроме эс-, пэ-, дэ-подуровней, заполняются и эф-подуровни третьего снаружи электронного слоя. К эф-элементам относятся лантаниды и актиниды, которые вынесены за пределы таблицы.
В группах находятся элементы, атомы которых имеют схожее электронное строение. Группы делят на А и Б подгруппы: это главная и побочная. А группа содержит больше элементов, чем побочная.
Заполнение внешнего энергетического уровня
У элементов А-групп последними заполняются эс- и пэ-подуровни внешних энергетических уровней, а у Б-групп последними заполняются дэ-подуровни второго снаружи или эф-подуровни третьего снаружи энергетического уровня.
Элементы первой А группы имеют один валентный электрон. Элементы второй А группы имеют два валентных электрона.
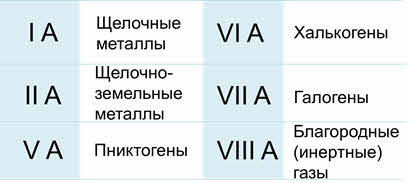
Некоторые главные подгруппы имеют свои названия: первая А группа – щелочные металлы, вторая А группа – щелочноземельные металлы, пятая А группа – пниктогены, шестая А группа – халькогены, седьмая А группа – галогены, восьмая А группа – благородные или инэртные газы.
Физический смысл номера группы заключается в том, что он показывает число электронов в атоме, которые могут участвовать в образовании химических связей.
Электроны, которые участвуют в образовании химической связи называются валентными. У элементов А-групп валентными являются электроны внешнего энергетического уровня, а у элементов Б-групп – ещё и электроны предпоследних уровней.
Следовательно, группа – вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
У каждой группы есть формула высшего оксида, то есть оксида с максимальной степенью окисления элементов. Эта информация написана внизу таблицы. Например, для элементов пятой А группы формула высшего оксида – эр-два-о-пять. В таблице отражен состав летучих водородных соединений. Такие соединения образуют элементы от четвёртой по седьмую группу.
Каждому элементу в Периодической системе отведено своё место. Однако для водорода в Периодической системе есть 2 места: в первой и седьмой группах. Водород, как и щелочные металлы, имеет один электрон на внешнем энергетическом уровне и относится к эс-семейству, поэтому он, как и щелочные металлы проявляет восстановительные свойства.

Но до завершения внешнего энергетического уровня водороду не хватает одного электрона, как и галогенам, поэтому он может проявлять и окислительные свойства.
Молекула водорода, как и молекулы галогенов, состоит из двух атомов, связь между атомами ковалентная неполярная.

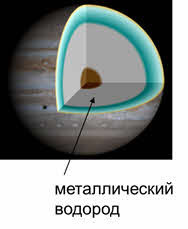
Но в космосе существует металлический водород, который имеет металлическую кристаллическую решётку и обладает электропроводимостью. Как и у щелочных металлов, у водорода в соединениях степень окисления плюс один, но в гидридах у водорода степень окисления минус один.
Как известно, Берцэлиус определил атомные массы сорока пяти химических элементов и в 1818 году опубликовал их в виде таблицы. Для обозначения химических элементов Берцэлиус предложил использовать начальные буквы их латинских названий. Берцелиус открыл новые химические элементы: цэрий, селен и торий. Ему первому удалось получить в свободном состоянии кремний, титан, тантал, цирконий, а также ванадий.
Таким образом, периодический закон стал важным звеном в эволюции атомно-молекулярного учения, оказав значительное влияние на разработку теории строения атома. Он также способствовал формулировке современного понятия "химический элемент" и уточнению представлений о простых и сложных веществах.

Периодический закон и Периодическая система позволили:
· установить взаимосвязь между элементами и объединить их по свойствам;
· обнаружить повторяемость свойств элементов и их соединений и объяснить их причину;
· исправить и уточнить значения относительных атомных масс некоторых элементов;
· исправить и уточнить степени окисления некоторых элементов;
· предсказать существование ещё неоткрытых элементов, описать их свойства, указать пути их открытия.
Следовательно, главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный номер, находится в определённом периоде и определённой группе.

 Получите свидетельство
Получите свидетельство Вход
Вход





 8013
8013

