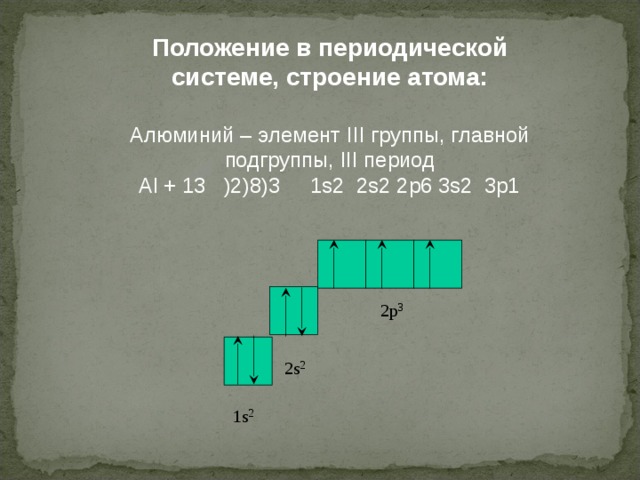
Положение в периодической системе, строение атома:
Алюминий – элемент III группы, главной подгруппы, III период
Al + 13 )2)8)3 1s2 2s2 2p6 3s2 3p1
2p 3
2 s 2
1 s 2

Нахождение в природе :
В свободном виде не встречается.
Содержание в земной коре: 9%
1 место среди металлов
3 место среди элементов
Соединения алюминия: силикаты, глины.
AI 2 O 3 – (корунд, рубин, сапфир)
KAISi 3 O 10 – ортоклаз
NaAISi 3 O 10 – альбит
Ca ( AISiO 4 ) 2 – анортит
KNaAISiO 4 – нефелин
Na 3 AIF 6 – криолит
AI 2 O 3 * х H 2 O - боксит

AI 2 O 3 – (корунд, рубин, сапфир)

KAISi 3 O 10 – ортоклаз

NaAISi 3 O 10 – альбит

KNaAISiO 4 – нефелин

Na 3 AIF 6 – криолит

AI 2 O 3 * х H 2 O - боксит
ИСТОРИЯ ОТКРЫТИЯ
Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году
Современный метод получения был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году.

Физические свойства
Металл серебристо-белого цвета, лёгкий
плотность — 2,7 г/см³
температура плавления - 660 °C
Пластичен, легко прокатывается в фольгу и протягивается в проволоку. Обладает высокой электро- и теплопроводностью.

Химические свойства
1. С кислородом - оксид
4Al + 3O 2 = 2Al 2 O 3
- 4Al + 3O 2 = 2Al 2 O 3
2.С хлором - хлорид
2Al + 3 CI 2 = 2Al C l 3
3. Со фтором - фторид
2Al + 3F 2 = 2AlF 3
4.С серой - сульфид
2Al + 3S = Al 2 S 3
5.С азотом - нитрид
2Al + N 2 = 2AlN
6.С углеродом - карбид
4Al + 3С = Al 4 С 3
- 2Al + 3 CI 2 = 2Al C l 3 3. Со фтором - фторид 2Al + 3F 2 = 2AlF 3 4.С серой - сульфид 2Al + 3S = Al 2 S 3 5.С азотом - нитрид 2Al + N 2 = 2AlN 6.С углеродом - карбид 4Al + 3С = Al 4 С 3
с простыми веществами:
![Со сложными веществами : с водой : 2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 2Al + 6H 2 O = 2Al(OH) 3 + 3H 2 со щелочами: 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2 Легко растворяется в соляной и разбавленной серной кислотах: 2Al + 6HCl = 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (р) = Al 2 (SO 4 ) 3 + 3H 2 2Al + 6HCl = 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (р) = Al 2 (SO 4 ) 3 + 3H 2 При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 8Al + 15H 2 SO 4 (к) = 4Al 2 (SO 4 ) 3 + 3H 2 S + 12H 2 O Al + 6HNO 3 (к) = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O 8Al + 15H 2 SO 4 (к) = 4Al 2 (SO 4 ) 3 + 3H 2 S + 12H 2 O Al + 6HNO 3 (к) = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O Восстанавливает металлы из их оксидов: 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr](https://fsd.videouroki.net/html/2018/07/27/v_5b5afeb5c0b8b/img11.jpg)
Со сложными веществами :
- с водой :
2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
- 2Al + 6H 2 O = 2Al(OH) 3 + 3H 2
- со щелочами:
2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
- 2Al + 2NaOH + 6H 2 O = 2Na[Al(OH) 4 ] + 3H 2
- Легко растворяется в соляной и разбавленной серной кислотах:
2Al + 6HCl = 2AlCl 3 + 3H 2
2Al + 3H 2 SO 4 (р) = Al 2 (SO 4 ) 3 + 3H 2
- 2Al + 6HCl = 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 (р) = Al 2 (SO 4 ) 3 + 3H 2
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия:
8Al + 15H 2 SO 4 (к) = 4Al 2 (SO 4 ) 3 + 3H 2 S + 12H 2 O
Al + 6HNO 3 (к) = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O
- 8Al + 15H 2 SO 4 (к) = 4Al 2 (SO 4 ) 3 + 3H 2 S + 12H 2 O Al + 6HNO 3 (к) = Al(NO 3 ) 3 + 3NO 2 + 3H 2 O
- Восстанавливает металлы из их оксидов:
8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe
2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr
- 8Al + 3Fe 3 O 4 = 4Al 2 O 3 + 9Fe 2Al + Cr 2 O 3 = Al 2 O 3 + 2Cr
![AI(OH) 3 гидроксид алюминия получение AICI 3 +3 NaOH = AI(OH) 3 + 3NaCI Взаимодействие с соляной кислотой AI(OH) 3 + 3HCI = AICI 3 + 3H 2 O Взаимодействие со щелочью AI(OH) 3 + NaOH = Na [AI(OH) 4 ] гидроксоалюминат натрия](https://fsd.videouroki.net/html/2018/07/27/v_5b5afeb5c0b8b/img12.jpg)
AI(OH) 3 гидроксид алюминия
получение
AICI 3 +3 NaOH = AI(OH) 3 + 3NaCI
Взаимодействие с соляной кислотой
AI(OH) 3 + 3HCI = AICI 3 + 3H 2 O
Взаимодействие со щелочью
AI(OH) 3 + NaOH = Na [AI(OH) 4 ] гидроксоалюминат натрия

ПРИМЕНЕНИЕ
- авиа- и автомобилестроение
- взрывчатые вещества
- изготовление мебели, посуды
- провода, химическая аппаратура, фольга, зеркала
- алюминиевая пудра (краска по «серебро»)

СПЛАВЫ АЛЮМИНИЯ
- силумин ( алюминий + кремний)
- дюралюминий ( + Mg Fe Cu Mn )
- магналий ( + Mg)

СОЛИ АЛЮМИНИЯ
AICI 3 – катализатор в органическом синтезе
AI 2 ( SO 4 ) 3 – очистка воды, производство бумаги
AI 2 ( SO 4 ) 3 * 18 H 2 O – протравливание тканей при окрашивании х/б тканей
KAI ( SO 4 ) 2 *12 H 2 O - дубление кож.

 Получите свидетельство
Получите свидетельство Вход
Вход












 "Алюминий и его соединения" (1.69 MB)
"Алюминий и его соединения" (1.69 MB)
 0
0 893
893 21
21 Нравится
0
Нравится
0


