

кератин – рога, шерсть
коллаген – кожа
гемоглобин – кровь
фибрин, фибриноген – кровь
пепсин – желудочный сок
трипсин – поджелудочный сок
миозин – мышцы
глобулин – вакцина
родопсин – зрительный пурпур
птиалин – слюна
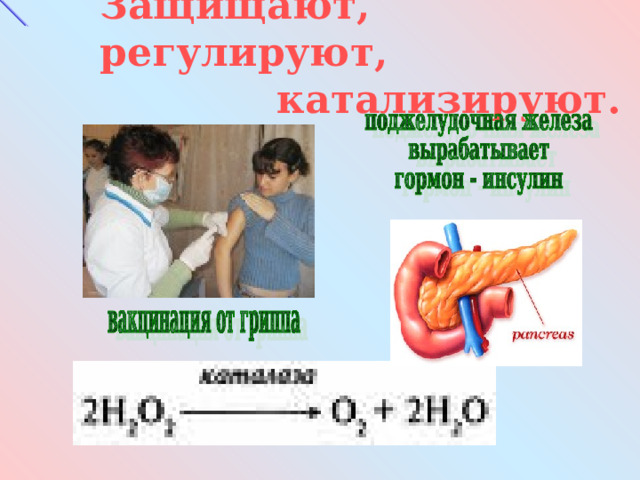
инсулин – поджелудочная железа
казеин – молоко
альбумин – яичный белок

Эмиль Герман Фишер
выдвинул полипептидную теорию строения белков, заложил основы их химического синтеза, синтезировав полипептиды, состоящие из 19 аминокислотных остатков.
Я. Беккари
А.Я Данилевский
указал на наличие пептидных групп в белковой молекуле.


Альбумин
– белок яйца C 237 H 386 O 78 N 58 S 2
Белок молока
– казеин C 1864 H 3012 O 576 N 468 S 21
Одно звено гемоглобина
– C 738 H 1160 O 208 N 203 S 2 Fe



Зачем маринуют мясо?


В чем причина образования пены на поверхности мясных бульонов, жареных, рыбных, и мясных изделий?


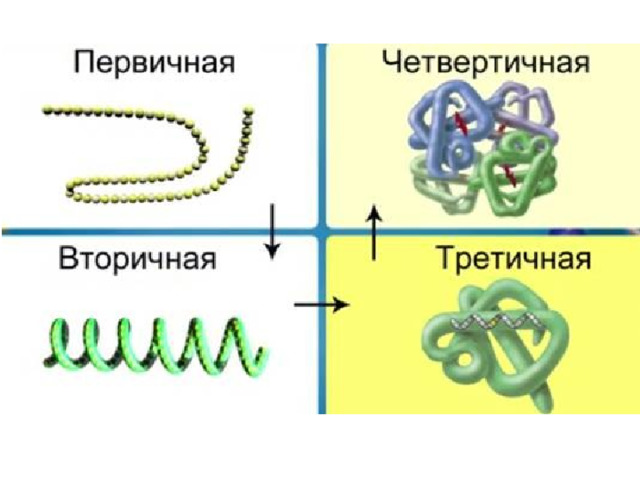
Структура белковой молекулы
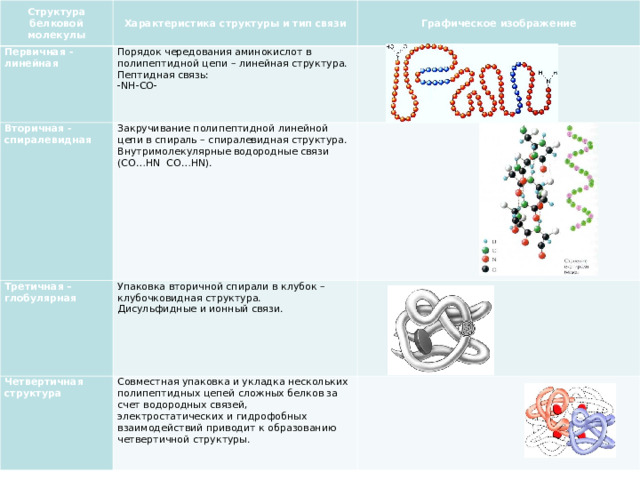
Характеристика структуры и тип связи
Первичная - линейная
Графическое изображение
Порядок чередования аминокислот в полипептидной цепи – линейная структура. Пептидная связь:
- NH-CO-
Вторичная -спиралевидная
Третичная – глобулярная
Закручивание полипептидной линейной цепи в спираль – спиралевидная структура.
Внутримолекулярные водородные связи ( CO … HN CO … HN ).
Упаковка вторичной спирали в клубок – клубочковидная структура.
Дисульфидные и ионный связи.
Четвертичная структура
Совместная упаковка и укладка нескольких полипептидных цепей сложных белков за счет водородных связей, электростатических и гидрофобных взаимодействий приводит к образованию четвертичной структуры.

Очень ценно
из-за богатого содержания белка
Разлить бульон
(с растворенным желатином) по формочкам
Белок фиброин - превосходный эффект немедленного лифтинга

Защищают, регулируют, катализируют.



1. Первичная структура белка удерживается:
а) водородными связями;
б) пептидными связями;
в) гидрофобными связями;
г) дисульфидными связями.
2. Вторичную структуру белковой молекулы поддерживают в основном … связи.
а) водородные;
б) ионные;
в) пептидные;
г) гликозидные.
3. Молекулы белков отличаются друг от друга:
а) последовательностью чередования аминокислот;
б) количеством аминокислот в молекуле;
в) формой третичной структуры;
г) всеми указанными особенностями.
4. Как поступают в клетки животных незаменимые аминокислоты?
а) синтезируются в самих клетках;
б) поступают вместе с пищей;
в) поступают вместе с витаминами;
г) поступают всеми указанными путями.
5. Полипептидная цепь, свернутая в клубок, – это … структура белка.
а) первичная;
б) вторичная;
в) третичная;
г) четвертичная.


 Получите свидетельство
Получите свидетельство Вход
Вход












 Изучение белков (2.08 MB)
Изучение белков (2.08 MB)
 0
0 234
234 2
2 Нравится
0
Нравится
0


