План урока по теме: «Гидролиз солей»
Цели урока:
Обучающая - формирование знаний о гидролизе солей, умений определять характер среды по составу солей;
Развивающая – формирование умений наблюдать, анализировать, сравнивать, выдвигать предположения, обобщать, делать выводы;
Воспитательная – формирование знаний о категориях диалектики: сущность и явление, единичное, общее.
Тип урока - урок изучения нового материала. Вид урока – беседа, лабораторные опыты.
Методы урока:
Обучения – диалогический, алгоритмический;
Преподавания – объяснительный, побуждающий, инструктивный;
Учения – репродуктивный, частично-поисковый, практический
Оборудование и реактивы:
Таблицы: «Растворимость солей, кислот и оснований в воде», « РН растворов» , проектор, презентация « Гидролиз солей»
Растворы: хлорида натрия, карбоната натрия, хлорида цинка, растворы кислот и щелочей, фенолфталеина, лакмуса; индикаторная бумага универсальная.
Химическая посуда: колбы стеклянные, химические стаканы.
Актуализация знаний и способов действия.
Опорные понятия: электролиты, электролитическая диссоциация, слабые и сильные электролиты, РН растворов кислот и щелочей.
Опорные умения: наблюдение, анализ, сравнение, выдвижение гипотез, обобщение, формулировка выводов.
Формирование новых понятий и способов действия:
Вновь вводимые понятия – гидролиз
Предполагаемые приращения знаний: понимание причин различного характера среды в водных растворах средних солей.
Создание проблемной ситуации в процессе выполнения демонстрационного эксперимента.
Основная проблема: Почему растворы солей имеют различный характер среды?
Способ решения выводится из механизма взаимодействия солей с водой.
Формирование умений и навыков.
Самостоятельная работа ( выполнение теста)
Домашнее задание: конспект урока, задание по определению характера среды.
Конспект урока
| Действия преподавателя | Действие учащихся |
| Вводное слово преподавателя: Тема нашего урока «Гидролиз солей». Слово « гидролиз» означает разложение под действием молекул воды. Гидролиз имеет огромное значение во всех обменных процессах в растительном и животном мире. Цель нашего урока - познакомиться с процессом гидролиза солей, научиться определять характер среды по составу соли. Вы знаете, что в растворах электролиты ( а к ним относятся соли, кислоты и основания, растворимые в воде) распадаются на ионы, положительные -катионы и отрицательные –анионы. Сущность химической реакции между растворами электролитов заключается в образовании слабых электролитов. Кто забыл, см таблицу слабых и сильных электролитов. Актуализация ранее полученных знаний. 1.Определить, какие из ионов не могут существовать в одном растворе и почему? Из приведенных ионов выбираем те, которые образуют слабые электролиты. 2. Какова бывает реакция среды в растворах? 3. Каким образом можно определить характер среды в растворах? 4. Как называют показатель , количественно оценивающий реакцию среды и какие значения он имеет в кислых, нейтральных и щелочных растворах? 5.Вспомним, каким образом происходит процесс диссоциации кислот ( написать уравнения). 6. Какой ион присутствует в растворах кислот? ( опыт – действие индикатора лакмуса на растворы кислот). 7. Написать уравнения реакций диссоциации щелочей. 8. Какой ион присутствует в растворах щелочей? (Опыт – действие индикатора лакмуса на растворы щелочей.) Формирование новых понятий и способов действий А как ведут себя в растворе соли. Оказывается , что не так однозначно.Учащиеся готовят таблицу, далее эксперимент Испытание воды, и солей индикаторами, ( 4 колбы с растворами, индикаторная бумага, щипцы). По ходу эксперимента на доске запись уравнений диссоциации: NaCI = Na+ + CI- ZnCI2 = Zn2+ + 2CI- Na2CO3 = 2 Na+ + CO32- Присутствуют ли в растворе ионы водорода? Присутствуют ли в растворе гидроксид ионы? Какую среду в этих растворах мы предположим? Формулировка проблемы: в чем причина несоответствия между теорией и результатами эксперимента. Почему одна соль имеет нейтральную среду, другая кислую, третья - щелочную. 1случай. Рассматриваем состав соли – хлорида натрия. Соль образована сильной кислотой и сильным основанием. В растворе не образуется слабого электролита, реакция не возможна, гидролиз не идет. 2 случай - Рассматриваем состав соли :хлорид цинка. Соль образована сильной кислотой и слабым основанием. В результате реакции образуется слабый электролит. Идет гидролиз по катиону. ZnCI2 Z Если соль образована слабым основанием и сильной кислотой, гидролиз идет по катиону, который связывает гидроксид - ионы в слабый электролит. В результате образуется основная соль и кислота 3 случай. Рассматриваем состав соли: карбонат натрия. Соль образована сильным основанием и слабой кислотой. В результате реакции образуется слабый электролит. Идет гидролиз по аниону. Na2CO3 = 2 Na+ + CO32- N Если соль образована сильным основанием и слабой кислотой, гидролиз идет по аниону, который связывает ионы водорода в слабый электролит. В результате образуется кислая соль и щелочь Запишите определение гидролиза в тетрадь. Какие же соли подвергаются гидролизу? Каким образом можно определить характер среды без эксперимента. Работа с инструкцией ( раздел «Учимся определять характер среды») Рассматриваем примеры. Лабораторный опыт « Химия в быту» определяем характер среды мыла . Демонстрация. Сообщения учащихся Подвожу итог, выставляю оценки . Итак, мы познакомились с вами с процессами гидролиза, выяснили, что главная причина гидролиза в составе солей , которые могут подвергаться гидролизу . а также научились определять характер среды по составу соли. Домашнее задание: заполнить таблицу до конца. Определить характер среды | Выполняют опыты делают записи Отвечают на вопросы и делают записи Пишут уравнения в тетрадях, делают вывод о том, какие ионы характерны для кислот и оснований Работают с инструкцией для учащихся, готовят таблицу и заполняют ее по ходу эксперимента. Отвечают на вопросы, делают записи в таблице Пользуясь таблицей слабых и сильных электролитов, определяют, какой кислотой и каким основанием образована соль и устанавливают связь между составом соли и реакций среды данной соли в водном растворе Записывают вывод в тетрадь Работают с инструкцией. Отвечают ( только те, в состав которых входит ион слабого электролита.) Определяют по таблице, каким основанием и какой кислотой образована соль, предполагают характер среды Делают сообщения |
Таблица сильных и слабых электролитов
| Сильные электролиты | Слабые электролиты |
| Кислоты: HCI- соляная HNO3 –азотная H2SO4- серная HCIO4- хлорная HBr – бромоводородная HI – иодоводородная
Основания: NaOH – гидроксид натрия KOH – гидроксид калия LiOH- гидроксид лития RbOH – гидроксид рубидия Ca (OH)2 – гидроксид кальция Ba(OH)2 – гидроксид бария Sr(OH)2 – гидроксид стронция
Соли: Все растворимые соли | Кислоты: H2CO3 – угольная H2S- сероводородная H2SO3 – сернистая HCN- циановодородная HF- фтороводородная H2SiO3 –кремниевая HNO2 – азотистая Основания: NH4OH – гидроксид аммония Все нерастворимые основания (Cu (OH)2, Fe (OH)2, , Fe (OH)3 , AI(OH)3, Zn (OH)2 , Ni (OH)2, и др. Катионы: Fe OH+ , Fe OH2+, ZnOH+, Cu OH+, AI OH2+ и др. Анионы: HCO3- , HS-, HSO3-, и др. Соли: Все нерастворимые соли |
Значения водородного показателя (РН)
|
| Кислая среда
РН | Нейтральная среда
PH =7 | Щелочная среда
РН 7 |
| РН | 0 1 2 3 4 5 6 Усиление кислотности | 7 | 8 9 10 11 12 13 14 Усиление щелочности
|
Тема « Гидролиз солей» ( инструкция для учащихся)
Что должны знать:
Что называется гидролизом?
В каком случае происходит гидролиз солей.?
От каких факторов зависит гидролиз?
Как работать:
Начерти в тетради таблицу:
| Вещество | Основание | Кислота | Реакция среды, PH | Какие ионы преобладают | Как идет гидролиз |
| H2O | - | - | нейтральная | H+ = ОН- |
|
| NaCI | NaOH - | HCI - |
|
|
|
| Na2CO3 | NaOH - | H2CO3 - |
|
|
|
| ZnCI2 | Zn(OH)2 - | HCI - |
|
|
|
| Na2S |
|
|
|
|
|
| BaCI2 |
|
|
|
|
|
| AICI3 |
|
|
|
|
|
По мере выполнения эксперимента заносите результаты в таблицу.
Сделайте вывод : в каком случае происходит изменение характера среды?
Запишите выводы в тетрадь:
Гидролиз- это обменная реакция соли с водой, в результате которой происходит связывание ионов водорода (H+) или гидроксид- ионов (ОН-) с слабый электролит.
Гидролизу подвергаются соли, содержащие ион слабого электролита.
Гидролиз обратимый процесс, только незначительная часть ионов подвергается гидролизу.
Учимся определять характер среды
Чтобы определить реакцию среды, надо определить « родителей» соли ( кислоту и основание). Кто забыл, см. Таблицу сильных и слабых электролитов.
Общий принцип « кто сильнее - такая и среда».
Заполни 3 нижние строки таблицы
Выполни самостоятельную работу: какая реакция среды в растворах следующих солей:
| 1 вариант | 2-вариант |
| Какого цвета будет лакмус в растворах: МgCI2, K2SO4, K2SO3 | Какого цвета будет лакмус в растворах: K2CO3, FeCI2, Na2SO4 |
Приложение1
Сообщение учащегося
Гидролиз солей имеет практическое и биологическое значение.
Еще в древности в качестве моющего средства использовали золу. В состав золы входит карбонат калия, который в воде гидролизуется по аниону с образованием щелочной среды, водный раствор приобретает мылкость за счет образования гидроксид - ионов.В настоящее время мы используем мыло, основной компонент которого соль, образованная сильными щелочами и слабой кислотой, раствор имеет слабощелочную среду.При изжогах, которые вызваны избытком кислот в желудочном соке, мы употребляем пищевую соду, раствор которой имеет щелочную среду, поэтому происходит нейтрализация избытка кислоты.
Если кислотность почвы недостаточная, то у растений развивается болезнь хлороз, в этом случае в почву вносят сульфат аммония, имеющий кислый характер среды. Наоборот, при избытке кислотности вносят соли, дающие щелочную среду ( известкуют)
Очень важна роль этого процесса в полиграфии в процессе подготовки форм офсетной печати: светочувствительные слои, наносимые на металлические пластины, должны иметь определенное значение водородного показателя. Поэтому в состав этих слоев входят соли.

 Получите свидетельство
Получите свидетельство Вход
Вход





 nCI2 + НОН
nCI2 + НОН 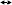 a2CO3 + НОН NaНCO3 + NaОН
a2CO3 + НОН NaНCO3 + NaОН










 Конспект урока химии в 11 классе по теме : "Гидролиз" (101 KB)
Конспект урока химии в 11 классе по теме : "Гидролиз" (101 KB)
 0
0 325
325 45
45 Нравится
0
Нравится
0


