Лекция 1.
Введение.
Основные понятия и законы химии
Составитель: преподаватель химии, биологии
Кутлиметова Зурета Ахмедовна
с. Красногвардейское – 2023
Лекция 1. Введение. Основные понятия и законы химии
План
Научные методы познания веществ и химических явлений
Значение химии при освоении профессий СПО технического профиля профессионального образования
Основные понятия химии
Основные законы химии
Научные методы познания веществ и химических явлений
Прежде чем приступить к любой работе и получить определённый результат, человек выбирает наиболее эффективные и доступные способы и приёмы выполнения её, инструмент и приспособления, которые можно использовать для этого, операции, которые необходимо совершить.
Совокупность приёмов и операций практического и теоретического освоения действительности и определяет понятие «метод».
Рассмотрим научные методы познания химии, т.е. методы познания, которые используются для изучения веществ и химических явлений.
Различают 2 уровня научного познания: эмпирический и теоретический.
Методы эмпирического уровня познания.
Эмпирический уровень - характеризуется исследованием реально существующих объектов. На этом уровне происходит процесс накопления информации об этих объектах с помощью следующих методов: наблюдение, измерение, постановка экспериментов.
В это же время осуществляется первичная систематизация получаемых фактических данных в виде описания, таблиц, схем, графиков и т.д.
Наблюдение – это первоначальный метод эмпирического познания, позволяющий получить первичную информацию об объекте изучения.
Наблюдение является целенаправленным, планомерным, активным методом научного познания: оно ведётся для решения заранее поставленных задач, строго по составленному исследователем плану, согласованному с поставленными задачами и сопровождается активными действиями исследователя. Результаты научных наблюдений фиксируются в виде описания признаков наблюдаемого объекта, таблиц, схем и т.д. Всё это является базисом науки, опираясь на который учёные создают эмпирические обобщения, сравнивают изучаемые объекты по тем или иным признакам, проводят классификацию, выявляют закономерности.
Наблюдения могут быть непосредственными, воспринимаемыми органами чувств человека, и опосредованными, которые проводятся с использованием технических средств наблюдения: микроскопов, телескопов и др.
В процессе наблюдения могут совершаться открытия новых явлений, позволяющих обосновать какую-либо научную гипотезу или подтвердить какое-либо положение известной теории.
Из всего сказанного следует, что наблюдение является важнейшим методом научного познания, позволяющим собрать обширную информацию об окружающем мире.
Эксперимент – более сложный метод эмпирического познания по сравнению с наблюдением. Он отличается от метода наблюдения тем, что в ходе эксперимента исследователь может изменять условия (давление, температуру, напряжение и т.д.), устранять побочные факторы, затрудняющие процесс исследования. Эксперимент может повторяться несколько раз для получения наиболее достоверных результатов.
Условия научного эксперимента: целенаправленность, наличие базы в виде исходных теоретических положений, наличие плана проведения эксперимента, наличие технических средств, наличие специалистов необходимого уровня квалификации.
В зависимости от характера поставленных задач, решаемых в ходе эксперимента, последние подразделяются на исследовательские и проверочные.
Исследовательские эксперименты направлены на обнаружение новых, неизвестных науке свойств изучаемого объекта. Результатом такого эксперимента могут быть выводы, изменяющие представления об этом объекте.
Проверочные эксперименты служат для проверки или подтверждения тех или иных теоретических положений.
Измерение – это процесс определения количественных значений свойств изучаемого объекта с помощью специальных технических устройств.
Измерения бывают прямые и косвенные.
Прямые измерения – это такие измерения, при которых значение измеряемой величины выдаётся непосредственно измерительным прибором.
При косвенном измерении искомое значение величины определяют по известной математической зависимости (по формуле), используя для этого данные, полученные при прямых измерениях.
В процессе измерения не всегда требуется участие человека. Измерение может быть включено в работу автоматической информационно-измерительной системы, которая строится на базе электронно-вычислительной техники.
Методы теоретического уровня познания.
Идеализация – представляет собой мысленное внесение определенных изменений в изучаемый объект в соответствии с целями исследований. В результате таких изменений могут быть исключены из рассмотрения какие-то свойства, признаки, стороны объектов. Например, в механике идеализация материальной точки как тела, лишенного размеров и массы. Такой прием удобен при описании движения, в том числе атомов и молекул.
Идеализация используется тогда, когда реальные объекты достаточно сложны для имеющихся средств математического анализа, когда некоторые свойства затемняют существо протекающих в объекте процессов.
Роль идеализации как метода научного познания заключается в том, что получаемые на его основе теоретические положения, можно использовать для исследования реальных объектов или явлений.
Формализация - заключается в использовании специальной символики, позволяет отвлечься от изучения реальных объектов и оперировать вместо этого символами (знаками). Достоинством формализации является возможность проведения исследований без обращения к какому-либо объекту, кроме этого обеспечивается краткость и четкость записи научной информации.
Методы, применяемые на эмпирическом и теоретическом уровнях познания.
Под анализом понимают разделение объекта (мысленно или реально) на составные части с целью изучения их по отдельности.
Под синтезом понимают соединение составных частей объекта (мысленно или реально) с целью изучения его как единого целого. Для изучения объекта как единого целого необходимо рассматривать его составные части в совокупности, в единстве. В процессе синтеза производится соединение воедино составных частей изучаемого объекта. Анализ и синтез успешно используются в сфере мыслительной деятельности человека, т.е. в теоретическом познании.
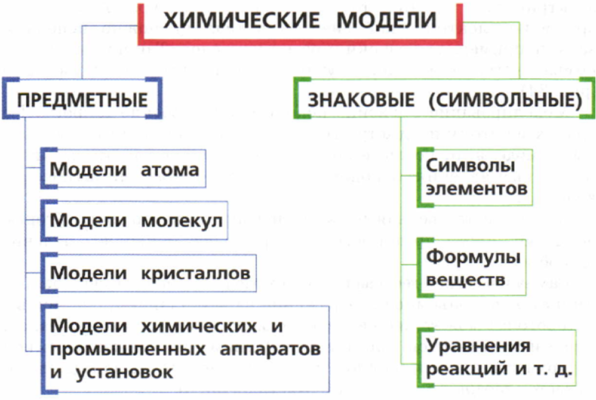
Моделирование – основано на изучении моделированного объекта. Модель строится по подобию оригинала, на ней воспроизводят, свойственные оригиналу процессы и полученные сведения переносятся на моделируемый объект – оригинал.
Различают несколько видов моделирования:
Мысленное. К нему относятся самые различные мыслительные представления в форме тех или иных воображаемых моделей.
Физическое. Оно характеризуется физическим подобием между моделью и оригиналом.
Символическое – связано с построением графиков, схем.
Численное моделирование на ЭВМ.
Моделирование как метод познания бывает единственно необходимым для исследования некоторых явлений.
Таким образом, все названные методы научного познания являются важными и необходимыми для познания окружающего мира.

.
Значение химии при освоении профессий СПО технического профиля профессионального образования
В нашем современном мире – в мире технологий самыми востребованными являются специальности технической направленности. А чтобы стать высококлассным специалистом, необходимо еще в школьные годы приложить свои усилия в изучении таких предметов, как физика, математика и химия.
Современное развитие строительства трудно представить себе без использования продукции химической промышленности: применения и внедрения новых конструкционных материалов, пластических масс, синтетических волокон, каучуков. Вяжущих и отделочных веществ и многих других. Внедрение таких процессов, как склеивание, сварка, формирование, - это результат химизации строительства. Использование быстротвердеющих бетонов и растворов стало возможным после тщательного и продуктивного исследования химических реакций их компонентов. Применение вяжущих веществ совершенствуется в ходе изучения процессов, реализующихся при их твердении. Синтетические полимерные материалы стали применять в строительстве из-за своей используемости в конструкционных прочных материалах, применения в качестве связующих, в дорожных покрытиях, тепло- и гидроизоляторов. Важными свойствами синтетических пластмасс являются их химическая стойкость к микроорганизмам. Широкое применение в строительных конструкциях получили стекло- и древесные пластики, полимербетоны, пенно- и сотопласты как отделочный материал, основные требования, относящиеся ко всем перечисленным материалам. Прежде всего, это высокая долговечность и достаточная механическая прочность. Широкое применение в дорожных покрытиях получили полимерцементные бетоны – затвердевшие смеси цемента и полимера с наполнителями или без них. Полимер, будучи равномерно распределен в бетоне, улучшает сцепление цементного камня с наполнителем и отдельных цементных зерен между собой. В последнее время особую популярность приобрели лакокрасочные материалы, полимерные материалы в качестве разнообразных защитных и декоративных покрытий.
Главная задача повара – готовить не только вкусную, но и здоровую пищу. Но чтобы овладеть всеми тонкостями искусства приготовления пищи, надо знать многое. Настоящий кулинар должен быть человеком, образованным в области химии, биологии, биохимии, физиологии питания. Ведь пища – это основа жизни, источник энергии. Без пищи жизнь не мыслима. Грамотный повар знает, что питание лишь тогда полноценно, когда пища содержит все питательные вещества в рациональном и нужном количестве. Знает взаимное влияние этих веществ.
Благодаря химическим открытиям А.Л. Лавуазье в наше время соблюдают баланс калорий, потребляемых человеком с пищей и расходуемых им при физической активности. Другой соотечественник А.О. Пармантье стал одним из основоположников в школе хлебопечения, агитировал за использование сахара, полученного из свеклы, винограда и других овощей и фруктов, предложил способы консервации продуктов питания.
Современная кухня во многом напоминает химическую лабораторию. С той лишь разницей, что кухонные полки заняты баночками, наполненными всевозможными крупами, специями и другими продуктами, а лабораторные – установлены склянками с не предназначенными для пищи реактивами. Вместо химических названий «хлорид натрия» или «сахароза» на кухне звучат более привычные слова «соль» и «сахар».
Автомобильный транспорт занимает ведущее место по сравнению с другими видами транспорта по объёму перевозок пассажиров и грузов.
Современный автомобиль состоит из 15—20 тысяч деталей , из которых 150—300 являются наиболее важными и требующих наибольших затрат в эксплуатации.
Автомобиль очень тесно связан с химией, т.к. для поддержания его в рабочем состоянии используются различные жидкости химического происхождения например: антифриз , моторное масло, трансмиссионное масло, тормозная жидкость, жидкость гидроусилителя, вода и т.д.
Основные понятия химии
Химия – наука о веществах, их строении, свойствах и превращениях.
Вещество – то, из чего состоят физические тела.
Физические свойства вещества – свойства, которые проявляются веществом в процессах, при которых вещество остаётся химически неизменным (агрегатное состояние, плотность, растворимость, температура кипения, температура плавления, цвет, вкус, запах и др).
Химические свойства – способность данного вещества превращаться в другие.
Явления – любые изменения, происходящие с веществом или физическом телом.
Физические явления – изменение формы тела или агрегатного состояния веществ, в результате которых не образуются новые вещества.
Химические явления – превращение одних веществ в другие (химические реакции).
Реагент – исходное вещество, которое вступает в химическую реакцию.
Продукт реакции – новое вещество, которое образуется в результате химических реакций
Изменение цвета FeCl3 (желтый) + 3KSCN (бесцветный) = Fe(SCN)2 (красный)+ KCl
Образование осадка BaCl2 + H2SO4 = BaSO4↓ + 2HCl
Выделение теплоты H2SO4 + 2NaOH + Na2SO4 + 2H2O + Q↑
Выделение газа Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Выделение света 2Mg + O2 =2MgO + hν↑
Атом – химически неделимая частица; электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Молекула – наименьшая частица вещества, сохраняющая его химические свойства; электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких атомов элементов, которая определяет химические свойства вещества.
Химический элемент – определенный вид атомов; совокупность атомов с одинаковым зарядом ядра.
Простое вещество образовано атомами одного элемента.
Сложное вещество – атомами разных элементов.
Аллотропия – способность химического элемента существовать в виде двух или нескольких простых веществ – аллотропных модификаций.
Аллотропные модификации – простые вещества, образованные атомами одного и того же элемента, имеющее разное число атомов в молекуле (кислород и озон) или разную структуру кристалла (графит, алмаз).
Химическая технология — наука о наиболее экономичных и экологически обоснованных методах химической переработки сырых природных материалов в предметы потребления и средства производства. Процессы химической технологии включают химическую переработку сырья, основанную на сложных по своей природе химических и физико-химических явлениях.
Неорганическая химическая технология включает переработку минерального сырья (кроме металлических руд), получение кислот, щелочей, минеральных удобрений.
Органическая химическая технология — переработку нефти, угля, природного газа и других горючих ископаемых, получение синтетических полимеров, красителей, лекарственных средств и других веществ.
Биотехнология – дисциплина, изучающая возможности использования живых организмов, их систем или продуктов их жизнедеятельности для решения технологических задач, а также возможности создания живых организмов с необходимыми свойствами методом генной инженерии.
Нанотехлогия – это наука о создании и использовании материалов, устройств и технических систем, функционирование которых определяется наноструктурой, то есть ее упорядоченными фрагментами размером от 1 до 100 нанометров.
Качественный состав – из атомов каких элементов состоит данное вещество.
Количественный состав – количество атомов того или иного элемента или атомных группировок, образующих данное химическое вещество.
Химическая формула – графическая запись, отражающая элементарный состав вещества.
Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы: атомы, ионы, группы атомов, образующих данное вещество.
Например, эмпирическая формула этана – СН3
Молекулярная (истинная) формула отражает качественный и количественный состав.
Например, истинная формула этана – С2Н6
Графическая формула – порядок соединения атомов.

Например, графическая формула этана –
Валентность – способность атомов элемента присоединять определенное число других атомов, образовывать определенное число связей с другими атомами.
I – ХЭ IA-гр., F.
II – ХЭ IIA-гр., Zn, Cd, О
III – Al.
Для определения валентности элементов с переменной валентностью в каком-либо данном соединении можно использовать правило валентности.
Согласно этому правилу, в большинстве бинарных соединений типа AmBn произведение валентности элемента А(х) на число атомов (m) равно произведению B (y) на число его атомов (n): x*m = y*n (не применяется для бинарных соединений, в которых атомы элементов непосредственно соединяются друг с другом H2O2)
Определим, например, валентность фосфора в следующих соединениях:
x I x’ II
PH3 P2O5
Валентность водорода валентность кислорода
Постоянная и равна I постоянная и равна II
x·1=1·3 x’·2=2·5
x=3 x’=5
III I V II
PH3 P2O5
Фосфор в PH3 является фосфор в P2O5 является
Трехвалентным элементом Пятивалентным элементом
Используя правило валентности, можно составлять формулы бинарных соединений, т.е. определять индексы в этих формулах.
Составим, например, формулу соединения алюминия с кислородом. Аl и О имеют постоянные значения валентности, соответственно III и II:
III II
Al O
Наименьшее общее кратное (НОК) чисел 3 и 2 равно 6. Разделим НОК на валентность Аl: 6:3=2
и на валентность О: 6:2=3.
Эти числа равны индексам у символов соответствующих элементов в формуле соединения: Al2O3.
Абсолютная атомная масса (ma) – масса атомов, которая выражена в обычных единицах массы (кг или г).
ma(H) = 1,67 · 10 -24 г ma(C) = 19,93 ·10 -24 г ma(O) = 26,67 · 10 -24 г
В 1961 г. в химии и физике была принята единая углеродная атомная единица массы (а.е.м) представляющая собой 1/12 массы атома угрерода-12.
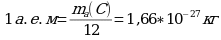
Относительная атомная масса элемента (Аr) – число, показывающее во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы атома углерода-12.
Относительная атомная масса элемента Х равна:

Рассчитаем, например, относительные атомные массы водорода и кислорода:
Аr (H) = ma(H) / 1 а.е.м. = 1,67 · 10 -27/ 1.66 · 10 -27 = 1
Аr (O) = ma(O) / 1 а.е.м. = 26,67 · 10 -27 / 1.66 · 10 -27 = 16
Таким образом, масса атома водорода приблизительно равна массе 1/12 части атома углерода, а масса атома кислорода приблизительно в 16 раз больше массы 1/12 части атома углерода.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса.
Например, Мr (N2O3) = Ar (N) · 2 + Ar (O) · 3; Мr (N2O3) = 14 · 2 + 16 · 3 =78.
Относительная молекулярная масса вещества (Мr) – число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1 /12 части абсолютной массы атома углерода-12.
Например, относительная молекулярная масса воды Мr (H2O) = 18. Это значит, что масса молекулы воды в 18 раз больше 1/12 части массы атома углерода.
Обратите внимание, что относительные величины, являются безразмерными.
«Доля» означает часть от целого. Это универсальное математическое понятие.
Массовая доля элемента ω(Э) % - это отношение массы данного элемента m (Э) во взятой молекуле вещества к молекулярной массе этого вещества Mr (в-ва).


Количество вещества (n) характеризуется числом атомов, молекул или других формульных единиц данного вещества, т. к. вещество состоит из большого количества частиц, то количество вещества удобно измерять в крупных единицах, содержащих большое число частиц.
В международной системе единиц (СИ) за единицу количества принят моль.
Моль – количество вещества, которое содержит столько молекул (атомов) этого вещества, сколько атомов содержится в 12 г (0,012 кг) углерода-12.
Т.к. масса атома углерода-12 равна 1,993·10 -23 г, то в 12 г углерода содержится:
![]()
Поэтому можно дать следующее определение моля:
Моль – такое количество вещества, в котором независимо от агрегатного состояния, содержит 6,02 · 10 23 структурных единиц (молекул, атомов) вещества.
Говоря о количестве вещества, всегда точно надо знать из каких структурных единиц состоит данное вещество. Например:
1 моль железа – 6,02 · 10 23 атомов Fe, т.к. железо состоит из атомов
1 моль воды – 6,02 · 10 23 молекул H2O, т.к. вода состоит из молекул
1 моль хлорида натрия – 6,02 · 10 23 условных молекул NaCl, т.к. хлорид натрия состоит из ионов.
1 моль CuSO4· 5H2O - 6,02 · 10 23 структурных единиц, каждая из которых состоит из одной условной молекулы CuSO4 и пяти молекул H2O
Число 6,02 · 10 23 называется постоянной Авогадро (NA). Указывает число структурных единиц в одном моле вещества: NA= 6,02 · 10 23 моль -1.
Количество вещества (n) равно отношению данного числа структурных единиц (N) к числу структурных единиц в 1 моле (NА):

Молярная масса (M) – масса 1 моль вещества.
Рассчитаем молярную массу, т.е. массу 1 моль воды. Мr (H2O) = 18. Следовательно, масса молекулы воды в атомных единицах массы равна 18 а.е.м. Т.к. 1 а.е.м. = 1.66 · 10 -24 г, то ma(H2O)= 18 · 1,66 · 10 -24 г. Масса одного моля воды равна произведению абсолютной молекулярной массы в г на число молекул в 1 моле:
М = ma(H2O) · NA = 18 · 1,66 · 10-24 г · 6,02 · 10 23 моль -1 = 18 г/моль.
Молярная масса вещества численно равна относительной молекулярной массе этого вещества. Если вещество состоит из атомов, то его молярная масса равна численно относительной атомной массе.
Определим, например, молярные массы водорода Н2, железа Fe и глюкозы С6Н12О6
Mr (H2) = 2 = M (H2) = 2 г/моль
Mr (C6H12O6) =180 = M (C6H12O6) = 180 г/моль
Вещество Fe состоит из атомов, поэтому его молярная масса численно равна относительной атомной массе: Ar(Fe) = 56 = M(Fe)= 56 г/моль
Отметим, что в 2 г водорода содержится одинаковое число молекул, равное числу Авогадро. Такое же число атомов содержится в 56 г железа.
Зная молярную массу вещества М, можно рассчитать количества вещества (число молей) n в любой данной массе m этого вещества по формуле:

Объединяя формулы, получим:
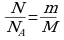
Основные законы химии
Закон сохранения массы (1748 г. М.В. Ломоносов, 1789 г. А. Лавуазье):
«Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции».
С точки зрения атомно-молекулярного учения: при химических реакциях атомы не исчезают и не могут возникнуть из ничего; общее число атомов остается постоянным до и после реакции.
H2 + Cl2 = 2HCl
2г 71г 73г
Задача 1. Какая масса воды образуется при сгорании 1 г глюкозы C6H12O6, если реакция протекает по схеме:

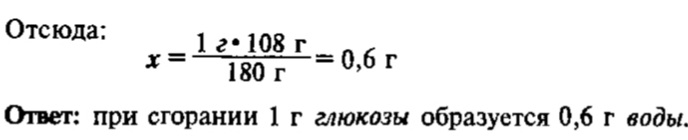
Достаточно часто при протекании химических реакций происходят «потери» веществ или имеет место неполное превращение исходных веществ в продукты реакции, в результате чего практически образующаяся масса (объем) того или иного продукта реакции оказывается меньше, чем теоретически рассчитанная по уравнению реакции. В этом случае говорят о практическом выходе, или просто выходе продукта реакции, который обозначается η (эта):



где mпрак., Vпрак., nпрак. – практически образующиеся масса, объем, количества продукта реакции соответственно,
mтеор., Vтеор., nтеор. – теоретически рассчитанные масса, объем, количества продукта реакции соответственно.
Задача 2. При разложении 42 г карбоната магния MgCO3 по уравнению:
MgCO3 = MgO + CO2↑ образовалось 19 г оксида магния MgO. Чему равен выход MgO?


Закон постоянства состава веществ (1799 г. Жозеф Луи Пруст):
«Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав».
С + О2 = СO2↑
CH4 + 2О2 = CO2↑ + 2H2O
2HCl + CaCO3 = CaCl2 + H2O + CO2↑ == углекислый газ имеет один и тот же состав СО2
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава (Н.С. Курнаков). Первые названы – дальтониды, вторые – бертоллиды (Бертолле – предвидевший такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами (СH4, CO2, SO2). Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям (оксид урана (III) - UO2,5 – UO3) – оксиды, гидриды, сульфиды, нитриды, карбиды и силициды, имеющие кристаллическое строение.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
«Состав соединений молекулярной структуры, т.е. состоящих из молекул, является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной, металлической решеткой) не является постоянным и зависит от условий получения».
VO - состав зависит от температуры и давления кислорода, применяемого при синтезе.
Закон Авогадро (1811):
«В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул»:

V1 = V2
T1 = T2 == N1 = N2
р1 = р2
Следствия из закона:
1. Одинаковое число молекул различных газов при одинаковых условиях (температуре и давлении) занимает одинаковый объем:

N1 = N2
T1 = T2 == V1 =V2
р1 = р2
2. При н.у. (T = 273 K, p = 1 атм (101,325 кПа)) 1 моль любого газа занимает объем 22,4л.
![]()

Задача 3. Какой объем при н.у. занимают: а) 2 моль любого газа; б) 7 г азота N2?

3. Массы равных объемов различных газов, взятых при одинаковых условиях, относятся друг к другу как их молярные массы.
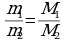
Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях) называется плотностью первого газа по второму (обозначается буквой D):
![]()
где x, y – сравниваемые газы.

М асса 1 моль газа равна M,
асса 1 моль газа равна M,
==
а объем – VM
![]()
![]()

Часто плотности различных газов определяют по отношению к водороду, воздуху.
Dн2(N2) = 28/2 = 14
Dвозд(Сl2) = 71/29 = 2,45*
*Mвоздуха = (4·28 + 1·32) / 4 + 1 = 28,8 г/моль (29 г/моль)
4V(N2) : 1V (O2)
28 32
Задача 4. Чему равна относительная плотность углекислого газа CO2 по: а) водороду; б) по воздуху?

Закон объемных отношений (Жозеф Луи Гей-Люссак):
«Объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа».
H2 + Cl2 = 2HCl
1л 1л 2л
2SO2 + O2 = 2SO3
2л 1л 2л
Молекулы простых газов состоят одинаковых атомов.

Вопросы для контроля
Что изучает химия?
Дайте определение понятий «вещество», «тело», «свойство вещества». Приведите примеры.
К каким явлениям относятся: расплавление стекла, ржавление железной гвозди, почернение серебра, скисание молока, появление зеленого налета на бронзовых украшениях, испарение воды, гашение соды, появление накипи на стенках внутри чайника, таяние льда, гниение мяса, сгорание топлива, квашение капусты?
Какие из следующих названий относятся к физическим телам, а какие – к веществам: пластиковый стакан, кусок мела, капля масла, деревянный стул, серебряное кольцо, мрамор, медь, горелка, парта, доска, стекло, вода, медная монета?
Какие частицы называют атомами и молекулами?
Дайте определение понятий «химический элемент»
Охарактеризуйте явление аллотропии. Какие факторы его вызывают? Приведите примеры аллотпропных модификаций кислорода. Сравните их. Укажите фактор, который вызывает аллотропию этого элемента.
Что называют простым и сложным веществом?
Выберите формулы простых веществ из списка H2O, O3, N2, K, Cl2, NaNO3, CaO, H2SO4, P, Mg(OH)2, I2, H2.
Охарактеризуйте качественный и количественный состав следующих веществ: Cu(OH)2, H2Cr2O7, NH4NO3, C2H5COOH, Mg3N2, H3PO4, HNO3, Ca(NO2)2, Na2CO3, Li2SiO3, MnO2, As2O3, P2O5, C3H7OH.
Дайте определения понятий «относительная атомная масса», «относительная молекулярная масса».
В каких единицах измеряется количество вещества?
Что такое моль как единица количества вещества?
Что показывает постоянная Авогадро и чему она равна?
Сформулируйте закон постоянства состава и закон сохранения массы вещества?
Как используют на практике закон постоянства состава и закон сохранения массы вещества?
Какую информацию дают химическая формула и химическое уравнение?
Как рассчитывают молярный объем? В каких единицах он выражается?
Сформулируйте закон Авогадро. Какие следствия из этого закона имеют важное значение для химических расчетов?
Чему равен объем 1 моль газа при н.у.? Как он называется?
Какая связь между относительной молекулярной массой газа и относительной плотностью? Какую величину называют относительной плотностью? Как находят плотность одного газа по отношению к другому?
Благодаря какому закону было установлено, что молекулы простых газов таких, как водорода, кислорода, фтора, хлора, азота, двухатомны?
Сформулируйте закон объемных отношений. Как он используется на практике?
Задания для самостоятельной работы
Укажите валентности элементов в соединениях: NH3, CuO, P2O3, N2O, CaH2, AlBr3, Cl2O3, NaCl.
Составьте формулы соединений элементов с постоянными валентностями: кислорода с литием, кислорода с магнием, кислорода с алюминием, фтора с кислородом, водорода с кальцием, водорода с натрием, фтор с водородом, водорода с кислородом.
Вычислите относительные молекулярные массы:
а) Al(NO3)3 г) (CuOH)2CO3 ж) H2SiO3
б) BaBr2 д) KClO3, з) NaHCO3
в) Ca2N3. е) Ca(OH)2 и) AlPO4.
Какова массовая доля: а) серы в серной кислоте (H2SO4), б) азота в азотной кислоте (HNO3)?
Как рассчитывают молярный объем? В каких единицах она выражается?
Какую массу имеют порции веществ, соответствующие данному количеству вещества:
а) 0,5 моль BaCO3
б) 2,6 моль H2Se
в) 3,7 моль Ca(OH)2
г) 4,8 моль K2O
д) 5,9 моль H2Cr2O7?
Какое количество вещества содержится в:
а) 9 г H2O в) 189 г HNO3
б) 34 г NH3 г) 227 г K2SO4?
Рассчитайте число молекул, которое содержится в:
а) 1,5 моль CO в) 2,5 моль Co2O3
б) 2,4 моль H2CrO4 г) 5 моль H2S2O7.
Какую массу будут иметь:
а) 1,8 · 1024 структурных единиц NaCl в) 1,2 · 1024 молекул HF
б) 3,0 · 1023 атомов Ni г) 1,5 · 1023 структурных единиц SiO2?
Cколько атомов кислорода содержится в данных порциях следующих соединений:
а) 2 моль SO2 в) 6 моль HNO3
б) 3 моль RbOH г) 9 моль Сa3(PO4)2?
Заполните таблицу (одно значение)
| Вещество | Формула | Число частиц N | Масса m, г | Молярная масса М, г/моль | Количество вещества, моль |
| Вариант 1 | |||||
| Оксид бериллия | BeO | 7.5 · 10 23 | ? | ? | ? |
| Гидроксид кальция | Ca(OH)2 | ? | 148 | ? | ? |
| Фосфин | PH3 | ? | ? | ? | 6.5 |
| Бихромат аммония | (NH4)2Cr2O7 | 0,5 · 10 23 | ? | ? | ? |
| Вариант 2 | |||||
| Угольная кислота | H2CO3 | 1.5 · 10 23 | ? | ? | ? |
| Оксид алюминия | Al2O3 | ? | ? | ? | 8 |
| Бромид натрия | NaBr | ? | 309 | ? | ? |
| Гидроксид лития | LiOH | ? | ? | ? | 10 |
| Вариант 3 | |||||
| Ацетилен | C2H2 | 2.4· 10 24 | ? | ? | ? |
| Гидроксид цинка | Zn(OH)2 | ? | 44,5 | ? | ? |
| Гидрид кальция | CaH2 | ? | ? | 2 | ? |
| Ортофосфорная кислота | H3PO4 | ? | 539 | ? | ? |
Какой объем при н.у. будут иметь газы:
а) 3 моль кислорода в) 2,5 моль оксида азота (II)
б) 3 моль углекислого газа г) 6 моль гелия?
Какие количество вещества и массу будут иметь следующие объемы газов, взятые при н.у.:
а) 2,24 водорода в) 44,8 л угарного газа
б) 4,48 л азота г) 67,2 л хлороводорода?
Рассчитаете, какой объем при н.у. займут порции газа:
а) 32 г O2 в) 68 г NH3
б) 6,8 г H2S г) 4,2 г C3.
Какой объем при н.у. займут:
а) 1,5 · 1023 молекул CO в) 3 · 1023 молекул Cl2,
б) 1,2 · 1024 атомов Ne г) 1,8 · 1024 молекул CO2?
Какую массу меди надо взять, чтобы получить: а) 8 г оксида меди (II) б) 3,2 г меди?
2Cu + O2 = 2CuO
Вычислите объем кислорода (н.у), который потребуется для сжигания порошка магния массой а) 18 г., б) 2,4 г.
2Mg + O2 = 2MgO
Определите массу оксида меди (II) CuO, которая потребуется для получения 500 г нитрата меди (II) Cu(NO3)2, если выход в реакции взаимодействия оксида меди с азотной кислотой HNO3 составляет 92%?
Какой объем (н.у.) оксида серы (IV) SO2 необходимо окислить кислородом. Чтобы получить 20 г оксида серы (VI) SO3? Выход оксида серы (VI) 80%.
2SO2 + O2 = 2SO3
Вычислите объем кислорода (н.у.), необходимого для полного сжигания а) 2,24 л угарного газа б) 10 л сероводорода.
а) 2CO + O2 = 2CO2
б) 2H2S + 3O2 = 2SO2 + 2H2O
Вычислите относительные плотности:
а) гелия по воздуху
б) азота по хлору
в) угарного газа по аргону
г) хлора по кислороду
д) фтора по водороду
е) углекислого газа по воздуху.
Список использованной литературы
Волков, А.И. Химия: школьный курс в кратком изложении / А.И. Волков, И.И. Курило. – Минск: Литера Гранд; Книжный дом, 2016. – 224 с.
Габриелян, О.С. Химия для профессий и специальностей технического профиля: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. - М.: Академия, 2017. – 272 с.
Егоров, А.С. Химия: пособие-репетитор для поступающих в вузы / А.С. Егоров, К.П. Шацкая, Н.М. Иванченко и др. – Ростов н/Д.: Феникс, 2003. – 768с.
Кузнецова, Н.Е. Задачник по химии 8 класс: для учащихся общеобразовательных учреждений /Н.Е. Кузнецова, А.Н. Лёвкин.- М.: Вентага-Граф, 2012. – 128 с.
Хомченко, Г.П. Пособие по химии для поступающих в вузы / Г.П. Хомченко. – М.: Новая Волна, 1999. – 463 с
Ерохин Ю.М. Химия: учеб. для студ.учреждений сред. проф. образования / Ю.М. Ерохин. – 18-е изд., стер. – М.: Академия, 2014. – 400 с.
18

 Получите свидетельство
Получите свидетельство Вход
Вход












 Лекция. Введение. Основные химические понятия и законы (1009 KB)
Лекция. Введение. Основные химические понятия и законы (1009 KB)
 0
0 44
44 0
0 Нравится
0
Нравится
0


