Центросоюз Российской Федерации
Нижегородский Облпотребсоюз
ЧПОУ Нижегородский экономико-технологический колледж
Химия
|
| Методические указания по выполнению лабораторных и практических занятий для студентов специальности 19.02.10 «Технология продукции общественного питания» |
Быкова Т.Н., преподаватель химии
Арзамас 2020
Пояснительная записка
Методический комплект к лабораторным работам и практическим занятиям по дисциплине «Химия» составлен для студентов специальности 19.02.10 «Технология продукции общественного питания».
Выполнение этих работ формирует навыки и умения работать с химическими веществами, бережно относится к химическим реактивам, химической посуде, пользоваться физическими приборами. Эти работы способствуют закреплению знаний, полученных на теоретических занятиях.
Данный комплект помогает организовать работу студентов малыми группами, а так же индивидуально. При проведении лабораторных работ студенты учатся пользоваться таблицами, справочной литературой; собирать приборы, соблюдать правила техники безопасности. Студенты на практике изучают свойства веществ, которые уже изучили на теоретических знаниях, что повышает интерес к данной дисциплине.
Состав и содержание лабораторных работ и практических занятий направлено на реализацию требований ФГОСа.
Перечень лабораторных работ и практических занятий указаны в соответствии с рабочей программой данной дисциплины.
К каждой лабораторной работе разработаны методические указания по ее проведению. Студенты, при выполнении работы, пользуются инструкциями. В инструкции указаны: цель работы, оборудование, порядок выполнение работы, таблица, форма отчета, контрольные вопросы.
Оформление лабораторных работ и практических занятий и их оценка
Лабораторные работы оформляются в отдельной тетради, практические занятия могут быть в общей тетради конспектом лекций.
Студент оформляет работу в соответствии с методическими указаниями, данными в работе.
Оценка работы студента преподавателем осуществляется по результатам выполненных и оформленных заданий в форме зачета.
Список лабораторных работ и практических занятий
| Лабораторная работа № 1 | «Определение поверхностного натяжения жидкостей» |
| Лабораторная работа № 2 | «Определение зависимости скорости реакций от температуры и концентрации реагирующих веществ» |
| Лабораторная работа № 3 | «Определение тепловых эффектов растворения различных веществ в воде» |
| Лабораторная работа № 4 | «Определение рН среды различными методами» |
| Лабораторная работа № 5 | «Исследование процессов адсорбции активированным углем различных веществ из растворов» |
| Лабораторная работа № 6 | «Получение коллоидных растворов» |
| Лабораторная работа № 7 | «Свойства коллоидных растворов. Коагуляция» |
| Лабораторная работа № 8 | «Получение устойчивых эмульсий и пен, выявление роли стабилизатора» |
| Лабораторная работа № 9 | «Изучение процессов набухания и студнеобразования крахмала, желатина и различных видов зерен» |
| Лабораторная работа № 10 | «Кислородсодержащие органические вещества(спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты)» |
| Лабораторная работа № 11 | «Биологически важные органические вещества (углеводы, жиры, белки)» |
| Практическое занятие № 1 | «Решение задач на расчет энтальпий». |
| Практическое занятие № 2 | «Строение коллоидных частиц» |
| Практическое занятие № 3 | «Составление формул и схем строения» |
| Практическое занятие № 4 | «Составление формул и схем строения мицелл» |
Лабораторная работа№ 1
Тема: Определение поверхностного натяжения жидкостей.
Цель работы:
определить поверхностное натяжение мыльного раствора;
сравнить поверхностное натяжение мыльного раствора и поверхностное натяжение воды;
определить вязкость мыльного раствора;
сравнить вязкость мыльного раствора и вязкость воды;
объяснить, почему натяжение мыльного раствора меньше поверхностного натяжения воды, а вязкость мыльного раствора больше вязкости воды;
научиться пользоваться вискозиметром и сталагмометром.
Реактивы и оборудование :
пипетка, вискозиметр, большой химический стакан
термометр, секундомер, штатив, мыльный раствор, вода
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1. Определение поверхностного натяжения методом счёта капель.
Метод основан на счёте капель, которые вытекают из пипетки (сталагмометра) через капиллярное отверстие. Каждая капля отрывается от нижнего конца трубки только тогда, когда её масса преодолеет силу поверхностного натяжения жидкости. Чем больше поверхностное натяжение жидкости , тем больше по массе отрывающаяся капля жидкости , тем меньше капель получится из этого объёма жидкости .
Ход работы:
Укрепите сталагмометр вертикально в штативе, промойте его водой. Под сталагмометр поставьте стаканчик с водой. Медленно насосите воду выше верхней метки. После чего дайте жидкости стечь до верхней метки. Когда мениск жидкости проходит верхнюю отмету, начинайте отсчитывать капли. Как только мениск достигнет нижней отметки, отсчёт капель прекратите. Повторите опыт 3 раза и возьмите среднее число капель. Опыт повторите с мыльным раствором. Зная число капель воды и мыльного раствора, вычислите поверхностное натяжение жидкости / мыльного раствора / по формуле:
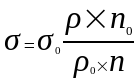
– поверхностное натяжение мыльного раствора
0 – поверхностное натяжение воды (0.= 72,75103 н/м)
0 – плотность воды (O =103кг/м3)
– плотность мыльного раствора (=0, 7894103кг/м3)
n0 – количество капель воды
n – количество капель мыльного раствора
Данные подсчёта капель занесите в таблицу:
| Жидкость | Количество капель | |||
| 1 раз | 2 раз | 3 раз | Среднее значение | |
| Вода |
|
|
|
|
| Мыльный раствор |
|
|
| |
Форма отчета:
Записать название опыта;
нарисовать сталагмометр;
провести опыт;
заполнить таблицу;
записать формулу для расчета ;
сделать расчет, указав единицы измерения;
объяснить, почему поверхностное натяжение воды больше, чем поверхностное натяжения раствора мыла
сделать вывод по результату опыта.
Опыт №2. Определение вязкости жидкости при помощи вискозиметра.
Вязкость любой жидкости определяют по отношению к вязкости воды, так как величина последней известна. Одинаковые объёмы исследуемой жидкости и воды пропускают через вискозиметр , измеряя время истечения жидкости.
Данные подставляют в формулу:

H2O- вязкость воды (H2O=0, 01П)
H2O- плотность воды (H2O =103кг/м3)
ж- плотность мыльного (ж = 0, 99103кг/м3)
- время истечения жидкости и воды в сек.
Ход работы:
Нижнее отверстие вискозиметра зажмите пальцем,
налейте в него воду до краёв;
приготовьте секундомер;
откройте отверстие вискозиметра и отметьте время, за которое истечёт вся жидкость;
опыт повторите 3 раза.
то же самое повторите с мыльным раствором.
результаты занесите в таблицу.
| Жидкость | Время истечения жидкости (мыльного раствора) в секундах | |||
| 1 раз | 2 раз | 3 раз | Среднее значение | |
| Вода |
|
|
|
|
| Мыльный раствор |
|
|
|
|
Форма отчета:
Записать название опыта;
нарисовать вискозиметр;
провести опыт;
заполнить таблицу по результатам опыта;
записать формулу для расчета ж;
сделать расчет, указав единицы измерения;
сделать вывод по результату опыта.
Контрольные вопросы.
1. В чём заключается сходство жидких и твёрдых тел?
2. Объясните, почему возникает поверхностное натяжение?
3. Как называются вещества, снижающие поверхностное натяжение жидкости и повышающие его. Приведите примеры.
4. Что такое вязкость жидкости? В каких единицах она измеряется?
5. От каких факторов зависит вязкость жидкости?
Лабораторная работа №2
Тема: Определение зависимости скорости реакций от температуры и концентрации реагирующих веществ.
Цели:
выяснить, как влияет на скорость химической реакции концентрация реагирующих веществ, температура;
вычислить скорость химической реакции, используя расчетные формулы;
выяснить, как влияет изменение концентрации на смещение химического равновесия;
экономно расходовать реактивы;
уметь делать выводы по результатам опыта.
Реактивы и оборудование :
гипосульфит натрия 0,1м Na2S2O3, серная кислота 0,1м H2SO4,
хлорид железа (III)FeCl3,
роданид аммония NH4CNS; хлорид аммония NH4Cl
прибор для нагревания, штативы, пробирки, термометры
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1 Зависимость скорости реакции от концентрации реагирующих веществ.
Na2S2O3 + H2SO4= Na2SO4 + Н2О + SO2 + S
Момент сливания растворов – начало реакции;
появление мути от выпавшей в осадок серы (до степени разведенного молока) – конец реакции
1). В три пробирки налейте раствор гипосульфита натрия Na2S2O3 ,
в первую - 1 мл,
во вторую - 2 мл,
в третью - 3 мл.
2). В первую пробирку прилейте 2 мл воды,
во вторую - 1 мл Н2О
третью - оставьте без изменений.
Какой раствор имеет большую концентрацию?
3). В каждую пробирку прилить 1 мл серной кислоты H2SO4 .
4). Отметьте время, прошедшее с момента добавления кислоты до момента появления мути цвета разбавленного молока от выпавшей в осадок серы ( в каждой пробирке)
5). Заполните таблицу по результатам опыта:
| № | Объем, мл | Продолжительность реакции (сек) | Скорость реакции | |
| Na2S2O3 | H2SO4 | |||
| 1 |
|
|
|
|
| 2 |
|
|
|
|
| 3 |
|
|
|
|
Форма отчета:
записать название опыта;
провести опыт;
заполнить таблицу;
сделать вывод по результату опыта.
нарисовать график изменения скорости реакции в зависимости от концентрации.
Опыт №2 Зависимость скорости реакции от температуры.
В три пробирки налейте по 1 мл гипосульфита натрия Na2S2O3, в другие три пробирки налейте по 1мл серной кислоты.
В первую пробирку с гипосульфитом натрия Na2S2O3, прилейте 1 мл раствора серной кислоты и взболтайте (без нагревания)
Заметьте время с момента добавления кислоты до момента помутнения.
Вторую пробирку с Na2S2O3 нагрейте до 500С
Слейте растворы гипосульфита натрия и серной кислоты и отметьте время, прошедшее с момента сливания до появления серы (мути).
Третью пробирку с гипосульфитом натрия нагрейте до 700С
Слейте растворы гипосульфита натрия и серной кислоты и отметьте время, прошедшее с момента сливания до появления серы (мути).
Заполните таблицу по результатам опыта:
| № | Объем, мл | Температура 0С | Продолжительность реакции (сек) | Скорость реакции | |
| Na2S2O3 | H2SO4 | ||||
| 1 |
|
| 20 |
|
|
| 2 |
|
| 50 |
|
|
| 3 |
|
| 70 |
|
|
Форма отчета:
записать название опыта;
провести опыт;
заполнить таблицу;
сделать вывод по результату опыта.
нарисовать график изменения скорости реакции в зависимости от концентрации.
Опыт №3 Химическое равновесие.
1). В пробирку налейте 10 мл воды и прилейте 1-2 капли растворов хлорид железа (III)FeCl3 и роданида аммония NH4CNS .
Произошла реакция: FeCl3+3NH4CNS =Fe(CNS)3+3NH4Cl .
2). Полученный раствор разлейте поровну в 4 пробирки .
3). В первую прилейте 1 мл раствора хлорид железа (III) FeCl3,
4). Во вторую 1 мл. раствора NH4CNS .
5). В третью положите несколько кристалликов NH4Cl , взболтайте .
6). Четвертую пробирку оставьте для сравнения.
Форма отчета:
записать название опыта;
провести опыт;
сделать вывод по результату опыта.
Контрольные вопросы.
1. Как изменится скорость реакции 2NO + O2 = 2NO2 , протекавшей в закрытом сосуде, если увеличить давление в 4 раза .
2. В каком направлении сменится равновесие при повышении давления:
CO(г)+Cl2(г)=COCl2(г) , H = -80кДж .
3. Как сместится равновесие при повышении температуры?
4. При t=1500C реакция заканчивается за 10 минут . Принимая температурный коэффициент равным 2 , рассчитать через какое время закончилась бы эта же реакция при 800С.
Лабораторная работа № 3.
Тема: «Определение тепловых эффектов растворения различных веществ в воде».
Цели:
на примере растворения различных веществ в воде познакомиться с тепловыми эффектами реакций при растворении;
научиться определять тепловой эффект реакции замещения меди из раствора ее соли алюминием;
научиться анализировать результаты экспериментов, делать выводы;
Реактивы и оборудование :
порошок алюминия, медный купорос (CuSO45H2O),
NaCl, KOH, NH4NO3 ,
весы, термометр, пробирки, стеклянная палочка
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1 Тепловые явления при растворении.
Взвесьте 5 грамм различных веществ: . NaCl, NH4NO3, KOH.
В три пробирки налейте по 20 мл воды.
Измерьте температуру воды в пробирках.
В первую пробирку всыпьте NaCl, и определите температуру растворения.
Во вторую пробирку всыпьте NH4NO3 , измерьте температуру растворения.
В третью пробирку - KOH, измерьте температуру .
Заполните таблицу:
|
№ | масса реактива | масса воды | температура воды | температура раствора | t |
| 1 |
|
|
|
|
|
| 2 |
|
|
|
|
|
| 3 |
|
|
|
|
|
Форма отчета:
Записать название опыта;
провести опыт;
заполнить таблицу;
записать формулу для расчета;
сделать вывод по результату опыта.
Опыт №2 Определение теплового эффекта реакции замещения меди из раствора ее соли алюминием.
Взвесьте на весах 2 грамма медного купороса.
Растворите соль в 10 мл воды в пробирке, измерьте температуру.
Взвесьте 0.5 грамм алюминиевого порошка.
Всыпьте порошок в раствор медного купороса.
Определите температуру раствора.
Количество выделившегося при реакции тепла рассчитайте по формуле:
Q=(mAl + mCuSO4 + mH2O) t C ,
где t -изменение температуры раствора,
С - удельная теплоемкость, (1)
Полученное количество теплоты выделится при взаимодействии 0.5 грамм алюминия.
Форма отчета:
записать название опыта;
провести опыт;
записать формулу для расчета;
сделать расчет и записать уравнение реакции с указанием теплового эффекта;
сделать вывод по результату опыта.
Контрольные вопросы:
1. Какие растворы называются насыщенными и перенасыщенными ?
2. Объясните, почему температура замерзания раствора ниже , чем температура замерзания растворителя ?
3. Объясните, почему температура кипения раствора выше, чем температура кипения растворения?
4. Какова нормальная концентрация раствора серной кислоты 9.8 грамма, которой растворено в 0.5 л. воды?
Лабораторная работа № 4
Тема: " Определение рН среды различными методами ".
Цели
научиться определять pH среды растворов, используя различные индикаторы;
уметь применять колориметрический метод анализа на практике, в своей профессии;
экономно расходовать реактивы.
Реактивы и оборудование
набор индикаторов, щелочь, кислота,
исследуемые растворы солей, буферный раствор.
штатив с пробирками.
При выполнении работы не забывайте о правилах Т.Б.
Опыт №1 Определение цвета индикатора в различных средах.
1. Налейте в одну пробирку 1 мл кислоты, в другую пробирку 1 мл щелочи.
2. Прибавьте в каждую пробирку 1-2 капли индикатора метилового оранжевого.
Повторите опыт с другими выданными индикаторами
Данные занесите в таблицу:
|
Индикатор | окраска | |
|
| в кислоте | в щелочи |
| 1. 2. |
|
|
Контрольные вопросы:
Что такое индикаторы?
Какие индикаторы изменяют окраску в щелочной среде?
Какие индикаторы изменяют окраску в кислой среде?
Какие индикаторы изменяют окраску и в щелочной и в кислой средах?
Что такое интервал перехода окраски индикатора?
Опыт №2 Определение рН растворов солей.
Перед началом проведения опыта тщательно промойте пробирки.
Налейте в 3 пробирки по 5 мл раствора соли.
В пробирки с раствором соли добавьте по 1-й капле разных индикаторов (в каждую пробирку 1 индикатор).
Несколько индикаторов используются для более точного определения рН среды.
Повторите опыт с растворами других солей.
Данные занесите в таблицу.
| Раствор соли | Индикатор | Цвет | рН |
|
|
|
|
|
Ответьте на вопрос: Почему растворы солей имеют различное значение рН?
Опыт №3 Буферные растворы..
Налейте в пробирку 1 мл буферного раствора.
Определите рН при помощи универсальной индикаторной бумажки.
Разлейте раствор в две пробирки.
Добавьте в первую - 0,5мл кислоты и определите рН при помощи универсальной индикаторной бумажки.
Добавьте во вторую - 0,5мл щелочи, определите рН при помощи универсальной индикаторной бумажки.
Ответьте на вопрос: Какие растворы называются буферными?
Форма отчета: Запись наблюдений по ходу опытов, ответы на поставленные вопросы, выводы по результатам опытов записывать в тетрадь.
Контрольные вопросы:
Как называется метод определения концентрации ионов водорода, основанный на изменении цвета индикатора?
Чему равна концентрация гидроксид-ионов в растворе, если концентрация инов водорода равна:[Н+]=10-5. Определите значение рН данного раствора.
Какое значение рН будет иметь раствор, если [Н+]=10-11.?
Лабораторная работа № 5.
Тема: «Исследование процессов адсорбции активированным углем различных веществ из растворов».
Цели:
познакомиться с явлением адсорбции на примере активированного угля;
выяснить зависимость адсорбции от природы адсорбента, от природы растворенного вещества;
познакомиться с практическим применением адсорбции на примере хроматографии.
Реактивы и оборудование :
активированный уголь, фуксин водный, фуксин спиртовый, Cо(NO3)2 , KI , I2, Pb(NO3)2 , FeCl3 , CuSO4 , Al2O3.
воронки , стаканы , пробирки, фильтровальная бумага.
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1 Адсорбция различных веществ из растворов.
Возьмите три пробирки:
в первую налейте 3 мл раствора йода (I2),
во вторую - 3 мл раствора CuSO4,
в третью - 3 мл синего лакмуса.
В каждую пробирку всыпьте 1 грамм активированного угля, хорошо взболтать
Через 3-4 мин. отфильтруйте смеси через воронку с фильтровальной бумагой.
Запишите наблюдаемые явления в таблицу:
| Вещество | Цвет до адсорбции | Цвет после адсорбции |
| Раствор йода |
|
|
| Раствор CuSO4, |
|
|
| Раствор синего лакмуса |
|
|
Форма отчета:
Записать название опыта;
провести опыт;
заполнить таблицу;
сделать вывод по результату опыта.
Опыт №2 Адсорбция ионов свинца углем.
В две пробирки налейте по 2мл раствора Pb(NO3)2 .
В одну пробирку прилейте 0,5 мл KI
В другую пробирку добавьте 1 грамм активированного угля,
взболтайте в течение 5 мин, затем профильтруйте.
К фильтрату прилейте также 0,5 мл раствора KI .
Форма отчета:
запишите название опыта;
проведите опыт;
запишите наблюдения,
приведите уравнение реакции между Pb(NO3)2 и KI .
сделайте вывод о возможности адсорбции не только молекул, но и ионов из растворов.
Опыт №3 Влияние природы растворителя на адсорбцию.
В одну пробирку налейте 3 мл водного раствора фуксина.
В другую 3 мл спиртового раствора фуксина.
Внесите в обе пробирки по 1 грамму активированного угля.
Взболтайте в течение 4 мин.
Профильтруйте растворы.
Форма отчета:
запишите название опыта;
проведите опыт;
запишите наблюдения,
сделайте вывод о степени адсорбции, учитывая правило адсорбции на твердых адсорбентах.
Опыт №4 Хроматографическое разделение солей.
Взять стеклянную трубку, плотно закрыть одно отверстие фильтрованной бумагой.
Заполните трубку на высоте 5-7 см. порошком оксида алюминия.
В пробирку налейте 5-6 капель смеси растворов солей Cо2+ , Cu2+ , Fe3+
Трубку спустите в пробирку со смесью и оставьте в покое на 10 мин.
Форма отчета:
запишите название опыта;
проведите опыт;
запишите наблюдения,
зарисуйте схему распределения ионов в трубке в процессе хроматографии
дайте определение понятия хроматографии
Контрольные вопросы:
Приведите примеры правил хранения продуктов на основании явления адсорбции .
Коробка противогаза содержит 40г. активированного угля. Какое количество хлора ( в мл) может быть поглощено противогазом, если 2,5г. активированного угля адсорбирует 235 мл. хлора при нормальных условиях?
Что такое адсорбция, абсорбция, адсорбент, адсорбтив?
Лабораторная работа № 6, 7.
Тема: «Получение коллоидных растворов. Свойства коллоидных растворов. Коагуляция».
Цели:
научиться на практике получать коллоидные растворы;
изучить некоторые свойства коллоидных растворов;
наблюдать изменение знака коллоида в зависимости от способа получения золя;
учиться анализировать результаты экспериментов, делать выводы.
Реактивы и оборудование :
растворы: FeCl3 , NH4OH , Hcl ,AgNO3 , KI , одеколон
штатив с пробирками, два стакана, нагреватель
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1 Получение золя гидроксида железа (III) методом пептизации.
Возьмите 5мл FeCl3 и прибавьте раствор аммиака по каплям до полного выпадения осадка гидроксида железа(III).
Полученный осадок промойте дистиллированной водой, после чего взболтайте его с большим количеством воды;
После отстаивания прозрачную жидкость над осадком осторожно слейте.
О конце отмывания судят по отсутствию запаха аммиака.
Промытый осадок разлейте поровну в две пробирки:
в одну прибавьте в качестве пептизатора 1мл. Hcl ,
другую - оставьте для сравнения .
Осадок с пептизатором следует взбалтывать и осторожно подогревать.
При наступлении пептизации получается красно-коричневый золь гидроксида железа(III).
Форма отчета:
Записать название опыта;
провести опыт;
написать уравнения реакций;
написать формулу мицеллы, указать ее части;
сделать вывод о способе получения золя.
Опыт №2 Получение золя гидроксида железа (III) методом гидролиза.
Приготовьте 10 мл кипящей дистиллированной воды.
Влейте в нее по каплям раствор хлорида железа(III) до получения коллоидного раствора красно-коричневого цвета.
Форма отчета:
Записать название опыта;
провести опыт;
написать уравнение реакции;
написать формулу мицеллы, указать ее части;
сделать вывод о способе получения золя.
Опыт №3 Изменение знака заряда коллоида в зависимости от способа получения.
Возьмите 2мл раствора нитрата серебра и добавьте из бюретки по каплям раствор иодида калия. В результате реакции образуется золь иодида серебра с положительно заряженной гранулой.
Возьмите 2мл. раствора иодида калия и добавьте из бюретки по каплям раствор нитрата серебра. В результате реакции образуется золь иодида серебра с отрицательно заряженной гранулой.
Форма отчета:
записать название опыта;
провести опыт;
написать уравнения реакций;
написать формулы мицелл, указать части;
сделать вывод по результатам опыта.
Опыт №4 Получение золя методом замены растворителя.
Налейте в пробирку 10 мл дистиллированной воды
капните туда несколько капель одеколона.
Наблюдайте образование опалесципующего золя.
Форма отчета:
записать название опыта;
провести опыт;
сделать вывод по результатам опыта..
Контрольные вопросы:
Перечислите методы получения золей.
Напишите формулу мицеллы золя Fe(OH)3 , полученного при взаимодействии FeCl3 и избытка NaOH. Назовите все части мицеллы, постройте графическую формулу мицеллы.
В чем проявляется действие стабилизатора?
Что понимают под агрегативной устойчивостью золей?
Что понимают под кинетической устойчивостью золей?
Лабораторная работа № 8
Тема: «Получение устойчивых эмульсий и пен, выявление роли стабилизаторов».
Цели:
уметь получать устойчивые эмульсии, пены, суспензии;
изучить действие стабилизатора (ПАВ);
на примере изоамилового спирта пронаблюдать действие пеногасителя;
экономно расходовать реактивы;
научиться анализировать результаты эксперимента, делать выводы.
Реактивы и оборудование :
раствор мыла, раствор белка, растительное масло,
изоамиловый спирт, раздробленный мел, крахмал,
штатив с пробирками, капиллярная трубка, пипетки, колбы
При выполнении работы не забывайте выполнять правила Т.Б.
Опыт №1 Получение эмульсии.
1) Приготовьте три пробирки:
в первую пробирку налейте 5 мл воды,
во вторую 5 мл раствора мыла,
в третью - 5 мл раствора белка.
2) Добавьте в каждую пробирку по 3-5 капель растительного масла
3) Взболтайте содержимое пробирок.
Форма отчета:
записать название опыта;
провести опыт;
записать наблюдения;
сделать вывод по результату опыта.
Опыт №2 Получение пены.
Налейте в колбочку 10-15 мл воды
Через капиллярную трубочку продувайте воздух.
Повторите опыт, заменив воду раствором мыла.
К полученной пене добавьте 1-2 капли изоамилового спирта
Форма отчета:
записать название опыта;
провести опыт;
записать наблюдения;
сделать вывод по результату опыта.
Опыт №3 Получение суспензии.
В две пробирки налейте воды.
в одну добавьте порошок мела,
во вторую - крахмал.
Содержимое обеих пробирок встряхните и отставьте.
Через 3-5 минут наблюдайте распад системы.
Форма отчета:
записать название опыта;
провести опыт;
записать наблюдения;
сделать вывод по результату опыта.
Контрольные вопросы:
Дайте определение эмульсиям.
Перечислите способы получения эмульсий. Перечислите эмульсии, применяемые в питании.
Дайте определение менам.
Перечислить пены, применяемые в питании.
Дайте определение суспензиям.
суспензий.
Перечислите суспензии, применяемые в питании.
Лабораторная работа № 9.
Тема: «Изучение процессов набухания и студнеобразования крахмала, желатина и различных видов зерен».
Цель работы: Формирование умений по определению степени набухания высокомолекулярных соединений.
Приобретаемые навыки и умения: Студенты смогут определять степень набухания высокомолекулярных соединений.
Оснащение рабочего места: пробирки мерные, желатин, 0,025 нормальные растворы HCl и NaOH, 0,1нормальные растворы KCl, NaCl, К2SO4, KCNS.
При выполнении работы не забывайте выполнять правила Т.Б.
Контрольные вопросы при допуске к лабораторной работе
1. Характеристика полимеров.
2. Какой процесс называют набуханием.
3. Набухание ограниченное и неограниченное.
4. Что называется студнем? Методы получения.
5. Применение студнеобразования в пищевой промышленности.
Методические рекомендации
Для выполнения работы необходимо знать строение и свойства полимеров. Условия набухания полимеров в различных средах. Какие по составу полимеры набухают в большей степени в полярных и неполярных растворителях.
ВЫПОЛНЕНИЕ РАБОТЫ
1. В семь мерных пробирок одинакового диаметра вносят по 0,3 г порошка желатина. Из соответствующих бюреток в каждую пробирку наливают по 5 мл различных растворов (см. таблицу 1). Пробирки осторожно встряхивают, чтобы частицы желатина опустились на дно, определяют высоту осадка желатина до набухания. После этого, встряхнув пробирки несколько раз, оставляют их в покое на 40 – 50 мин. По истечении этого времени каждую пробирку ещё раз встряхивают, дают осадку осесть, измеряют высоту набухшего осадка желатина (с каждой пробиркой измерения повторяют 2 раза). Данные заносят в таблицу.
Таблица 1
| № пробирки | Концентрация моль/ л | Приливаемый раствор | Высота осадка, мм | |||
| до набухания | после набухания | |||||
| 1 | - | Вода |
|
|
|
|
| 2 | 0,025 | HCl |
|
|
|
|
| 3 | 0,025 | NaOH |
|
|
|
|
| 4 | 0,1 | NaCl |
|
|
|
|
| 5 | 0,1 | KCl |
|
|
|
|
| 6 | 0,1 | К2SO4 |
|
|
|
|
| 7 | 0,1 | KCNS |
|
|
|
|
2. Кинетика, набухании зерна. Зерновые культуры (пшено, рис, лучше дробленый) ограниченно набухают в воде. Кинетику их набухания можно наблюдать в мерных цилиндрах (объемом не более 25 мл) или в калиброванных пробирках одинакового диаметра. Зерно насыпают в каждую пробирку (~1/3), но так, чтобы во всех пробирках было одинаковое количество зерна по высоте. Наливают' дистиллированную воду , чтобы вместе с зерном пробирки были заполнены на 3/4 объема. Наблюдения за процессом набухания проводят в течение 40-50 мин. Полученные данные заносят в таблицу по образцу:
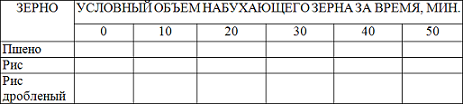
На основании экспериментальных данных строят график- кинетики набухания.
Вывод. На основании полученных данных делают вывод о влиянии кислоты, щелочи и солей на процесс набухания, а также о влиянии природы анионов.
Вопросы для защиты лабораторной работы
Чем отличается высаливание высокомолекулярного вещества от коагуляции золей электролитами?
Как влияет на свойства растворов белков изменение рН?
Где используются особенности диффузии низкомолекулярных веществ в студнях?
Явление синерезиса.
Как влияет на растворы высокомолекулярных соединений действие кислот, оснований, солей и почему?
Лабораторная работа № 10
Тема: Кислородсодержащие органические вещества(спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты)
Цель:
провести качественные реакции на карбоновые кислоты, фенолы, альдегиды, кетоны, одноатомные или многоатомные спирты, сложные или простые эфиры.;
уметь видеть связь между дисциплинами «Физическая и коллоидная химия» и «Технология приготовления пищи»;
Оборудование и реактивы: плитка, горелка, держатель, горючее, спички, пробирки, молоко свежее, колба, этиловый спирт, глицерин, фенол, формалин, ацетон, уксусная кислота.
При выполнении работы не забывайте о правилах Т.Б.
Ход работы
Свойства кислородсодержащих органические вещества
| Исследуемые вещества | Последовательность выполнения опытов. Физические свойства. Уравнения реакций. Замечания | Наблюдаемый результат |
| 1. Реакция с гидрокарбонатом натрия (открытие карбоновых кислот) | ||
|
уксусная кислота
| В пробирку наливают 1 мл раствора гидрокарбоната натрия (5), затем раствор уксусной кислоты (16) или неизвестного анализируемого вещества.
|
|
| 2. Реакция с бромной водой (открытие фенолов) | ||
|
фенол
| К водному раствору фенола (17) или анализируемого неизвестного вещества добавляют при встряхивании по каплям бромную воду (2). при наличии фенола сначала наблюдается обесцвечивание бромной воды, а при дальнейшем прибавлении реагента – образование мути и выпадение белого или окрашенного осадка.
|
|
| 3. Реакция с хлоридом железа (III) (открытие фенолов) | ||
|
фенол
| К водному раствору фенола (17) или анализируемого неизвестного вещества добавляют при встряхивании 1–2 капли 1%-ного раствора FeCl3 .
|
|
| 4. Окисление альдегидов гидроксидом меди (II) (открытие альдегидов) | ||
|
| Предварительно получают гидроксид меди. В пробирку помещают 10 капель 5%-ного раствора NaOH (6) и добавляют 1–2 капли 5%-ного раствора CuSO4 (7). К выпавшему осадку Cu(OH)2 добавляют 2–3 капли альдегида (41) или анализируемого неизвестного вещества, полученный раствор тщательно встряхивают. Затем медленно нагревают в пламени горелки пробирку до начала кипения постоянно встряхивая при этом. |
|
| альдегид
| В случае альдегида первоначально образуется гидроксид меди (I) желтого цвета, который при нагревании превращается в оксид меди (I) красного цвета.
|
|
| 5. Реакция с гидросульфитом натрия (открытие альдегидов и метилкетонов) | ||
|
ацетон
| На предметное стекло помещают 1 каплю насыщенного раствора бисульфита натрия (25) и прибавляют 1 каплю ацетона (18) или анализируемого неизвестного вещества. Образовавшуюся смесь перемешивают стеклянной палочкой. При наличии кетона или альдегида образуются кристаллы.
|
|
| 6. Образование гликоксидов с Cu (OH)2 (открытие многоатомных спиртов | ||
|
| Вначале готовят гидроксид меди. В пробирку помещают 3 капли 5%–ного раствора CuSO4 (7) и 4 капли 5%–ного раствора NaOH (6). Немедленно выпадает голубой осадок гидроксида меди Cu (OH)2. Затем добавляют 1–2 капли этиленгликоля (19) или анализируемого неизвестного вещества и раствор встряхивают.
|
|
| 7. Реакция с металлическим натрием. (открытие одноатомных спиртов) | ||
|
спирт этиловый
| Первоначально проводят реакцию обезвоживания этилового спирта. Для этого в сухую пробирку помещают 10 капель этилового спирта (20) или анализируемого неизвестного вещества, добавляют 0,1 г безводного сульфата меди (43), взбалтывают и дают отстояться. В другую сухую пробирку помещают маленький кусочек натрия металлического (42) и осторожно из первой пробирки приливают несколько капель обезвоженной жидкости.
|
|
| 8. Щелочной гидролиз сложного эфира в присутствии фенолфталеина. (открытие сложного эфира) | ||
|
этилацетат
| В пробирку приливают 4 капли этилацетата (21) или дибутилового эфира (51), или анализируемого неизвестного вещества, 5 капель воды (1), 1 каплю фенолфталеина (49), а затем добавляют 1 каплю 5%–ного раствора NaOH (6) до возникновения малинового окрашивания. Пробирку осторожно нагревают на пламени горелки, периодически встряхивая. Если окраска не изменяется, то пробирку, выносят из пламени, чуть охлаждают и добавляют ещё несколько капель анализируемого вещества. В случае сложного эфира окраска исчезнет, с простым эфиром изменения не наблюдаются.
|
|
Вывод: После выполнения данной части работы и оформления делают вывод о принадлежности вещества к соответствующему классу соединений.
Лабораторная работа № 11
Тема: Биологически важные органические вещества ( углеводы, жиры, белки).
Цель:
на примере тепловой обработке продуктов объяснить химическую суть происходящих процессов;
уметь видеть связь между дисциплинами «Физическая и коллоидная химия» и «Технология приготовления пищи»;
Оборудование и реактивы плитка, порционная сковорода, сырое яйцо, немного масла (для жарения), горелка, держатель, горючее, спички, большие пробирки, молоко свежее и несвежее (кислое). колба, вода, кусочек рыбы. вискозиметр, мерные стаканы (2 шт.), секундомер, фритюрный жир (до и после использования), стакан с водой, салфетки
При выполнении работы не забывайте о правилах Т.Б.
Опыт №1 Изменение белков при тепловой обработке
1.1. Изменение белков яйца при тепловой обработке.
Оборудование: плитка, порционная сковорода, сырое яйцо, немного масла (для жарения)
- Жарка яйца на сковородке
Назовите коллоидное состояние белков яйца до и после тепловой обработки.
Напишите схему изменения полноценных белков при тепловой обработке.
1.2. Изменение белков молока при тепловой обработке.
Оборудование: горелка, держатель, горючее, спички, большая пробирка, молоко (свежее).
-Вскипятите молоко (7-10 минут)
Назовите коллоидное состояние полноценных белков молока.
Что образуется на поверхности кипяченого молока?
Напишите схему изменения полноценных белков молока при тепловой обработке.
1.3. Изменение белков несвежего (кислого) молока при тепловой обработке.
Оборудование: горелка, держатель, горючее, спички, большая пробирка, молоко несвежее (кислое).
- Вскипятите молоко. (7-10 минут)
Назовите коллоидное состояние полноценных белков несвежего (кислого) молока.
Как изменяется коллоидное состояние несвежего молока в результате кипячения?
Напишите схему изменения полноценных белков молока при тепловой обработке.
1.4. Изменение белков рыбы при тепловой обработке.
Оборудование: плитка, колба, вода, кусочек рыбы.
- Налить в колбу воды, положить туда кусочек рыбы, довести до кипения и кипятить в течении 5 - 7 минут.
Запишите изменения, происходящие с сырой рыбой при тепловой обработке
Напишите схему изменения полноценных белков при тепловой обработке
Что произошло с соединительно - тканным белком (коллагеном ) при тепловой обработке?
Опыт № 2. Определение цвета и вязкости жира после жарки во фритюре.
Оборудование: вискозиметр, мерные стаканы (2 шт.), секундомер, фритюрный жир до и после использования, стакан с водой, салфетки
Имеется два мерных стакана на 100 мл . Один со свежим растительным маслом, второй - с прогретым в течении 5 часов при температуре 1800С (фритюрное)
Сравните и запишите цвет масла до и после прогревания.
Определите вязкость свежего и прогретого масла, используя вискозиметр и навыки, полученные при выполнении лабораторной работы №1.
Результаты опытов занесите в таблицу
| Жидкость | Время истечения жидкости | |||
|
| 1 | 2 | 3 | Среднее |
| Вода |
|
|
|
|
| Масло до использования |
|
|
|
|
| Масло после использования |
|
|
|
|
По полученным данным сделайте расчет вязкости фритюрного жира до и после жарки во фритюре.
Для расчета вязкости используйте формулу:

где: (H O) = 0,01П; (H O) = 1 г/см3; (масла) = 0,78 г/см3;
Вязкость жира до жарки 100%
Вязкость жира после жарки Х %
Определите на сколько % изменилась вязкость.
Фритюрные жиры при длительном нагревании и высокой температуре ( 1800С) претерпевают глубокие изменения. Многие продукты окисления и непредельные кислоты способны легко полимеризоваться, образуя высокомолекулярные соединения. При этом возрастает вязкость жира и снижается его усвояемость. Меняется и цвет жира - он темнеет.
1800С) претерпевают глубокие изменения. Многие продукты окисления и непредельные кислоты способны легко полимеризоваться, образуя высокомолекулярные соединения. При этом возрастает вязкость жира и снижается его усвояемость. Меняется и цвет жира - он темнеет.
Если вязкость жира возрастает более чем на 35% первоначального значения, то его нельзя использовать.
Сделайте вывод о возможности использования исследуемого фритюрного жира.
Форма отчета:
записать название опыта;
провести опыт;
записать наблюдения;
сделать вывод по результату опыта.
Контрольные вопросы
Что входит в понятие «режим варки» ?
Перечислите требования к качеству бульона.
Почему повышается вязкость фритюрного жира при длительном нагревании?
Как изменяется коллоидное состояние белков яйца после жарки?
Как изменяется коллоидное состояние белков свежего молока после кипячения?
Практическое занятие №1
Тема: «Решение задач на расчет энтальпий химических реакций»
Цели:
закрепить знание основных законов и понятий термодинамики и термохимии;
выработать умения и навыки по решению задач;
закрепить умения сравнивать, обобщать, работать с книгой, справочной литературой при выполнении работы.
Средства обучения: справочные материалы, учебники, конспект лекций, карточки – задания.
Ход работы.
Ответьте на вопросы:
1. Основные понятия термодинамики: система, фаза, параметры состояния систем, виды процессов.
2. Первый закон термодинамики . Энтальпия.
3. Термохимия: экзо- и эндотермические реакции.
4. Термохимические уравнения, их особенности.
5. Энтальпия образования, разложения, сгорания.
6. Основной закон термохимии. Закон Гесса.
7. Следствия из закона Гесса: 1 следствие из закона Гесса.
8. 2 следствие из закона Гесса.
9. Самопроизвольные процессы. Энтропия.
Решите предложенные задачи:
К-1
Каков стандартный тепловой эффет реакции ?
Fe2 O3 (т) + 2Al (т) = 2Fe (т) + Al2O3 (т)
Hобр(Al2O3)(т) = -1670 кДж/моль
Hобр(Fe2 O3)(т) = -821 кДж/моль
К-2
По стандартным тепловым эффектам сгорания этилового
спирта C2H5OH(-1370), уксусной кислоты (-876) и этилацетата
СH3COOC2H5(-2250) кДж/моль. Рассчитайте стандартный
тепловой эффект р-ции получения этилоцететата;
С2H5OH + CH3COOH = CH3COOC2H5 + H2O ?
К-3
Al2O3 (К) + 3SO3(Г)= Al2(SO4)3 (К);
H ХР -?
H обр (Al2O3) (к) = - 400,5 Дж/моль
H обр (SO3) (г) = - 94,6 Дж/моль
H обр (Al2 (SO4)3) (к) = -822,8 Дж/моль
К-4
Определите тепловой эффект р-ии этерификации щавеливой кислоты метиловым спиртом, протекающей по уравнению :
(COOH)2 + 2 CH3OH =(COOCH3)2 + 2H2O (СГОРАЕТ ДО H2O)
H сгор (COOH)2 (ж) = -60,1 кДж/моль
H сгор СH3OH (ж) = -173,65 кДж/моль
H сгор (COOH3)2 (ж) = -401 кДж /моль
Сдайте работу на проверку.
Практическое занятие №2
Тема: «Строение коллоидных частиц»
Цель:
уметь составлять формулу и схему мицеллы (указывать ее составные части)
Средства обучения: таблица растворимости, конспект лекций, тестовые задания
Ход работы.
Выполните задание самостоятельно, в случае затруднения сверьтесь с доской.
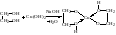
Строение коллоидных частиц может быть изображено лишь схематически, т.к. они не имеет определенного состава. Рассмотрим образование золя и строение его частиц на примере иодида свинца PbI2.Уравнение реакции имеет вид:
Pb2+ + 2I— = PbI2
Образование золя возможно, если к раствору Pb(NO3)2 постепенно прибавлять раствор KI или если к раствору KI постепенно прибавлять раствор Pb(NO3)2. При этом строение коллоидных частиц будет отличаться.
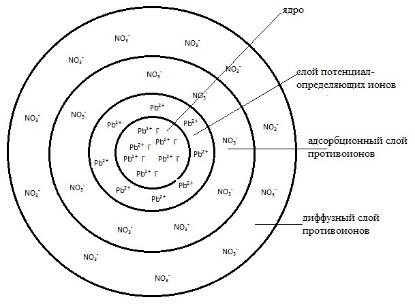
1. Предположим, что золь PbI2 образуется при постепенном прибавлении раствора KI к раствору Pb(NO3)2.
Вначале образуется агрегат (PbI2)m из ионов Pb2+ и I—.
Далее на поверхности агрегата адсорбируются ионы, входящие в его состав и находящиеся в растворе в избытке. В нашем примере это ионы свинца.
В результате этого, агрегат (PbI2)m с адсорбированным слоем Pb2+ приобретает положительный заряд. Адсорбированные на поверхности агрегата ионы и придающие ему заряд, называются потенциалопределяющими. А сам агрегат (PbI2)m с потенциалопределяющими ионами Pb2+, образуют ядро.
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы содержащиеся в растворе, но не входящие в состав агрегата. В данном примере – это нитрат-ионы NO3–.
Ядро и противоионы адсорбционного слоя образуют коллоидную частицу или гранулу, знак которой определяется знаком заряда потенциалопределяющих ионов.
Те же противоионы (NO3–), образуют и диффузный слой. По мере удаления от ядра, их содержание постепенно снижается.
Коллоидная частица вместе с противоионами диффузного слоя называется мицеллой.
Мицела в целом электронейтральна и не имеет строго определенных размеров.
Агрегат сравнительно прочно удерживает (связывает) противоионы адсорбционного слоя, а противоионы диффузного слоя испытывают действие электростатического притяжения разноименно заряженных ионов, удерживающее их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
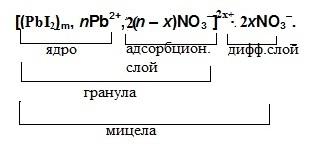
Формула мицеллы йодида свинца выглядит следующим образом:
2. Если же постепенно прибавлять раствор Pb(NO3)2 к раствору KI, то строение мицелы будет иным.
В этом случае, в избытке будут йодид-ионы, которые и будут адсорбироваться на поверхности агрегата (PbI2)m, образуя слой потенциалопределяющих ионов. В качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы калия. Строение мицеллы имеет следующий вид:
[(PbI2)m, nI–, (n – x)K+]x–xK+.
Т.к. гранула мицелы и ее диффузный слой – это заряженные частицы, то под действием электрического поля, они будут перемещаться к соответствующим электродам.
Итак, обобщая вышесказанное, приведем порядок написания формулы мицелы:
1) Ядро мицелы. Малорастворимое соединение, образуемое в результате реакции, составляет агрегат. Агрегат записывают в круглых скобках с индексом m.
2) Потенциалопределяющие ионы. Ионы, адсорбированные на поверхности агрегата и входящие в его состав, а также придающие ему заряд, находятся в растворе в избытке. Перед потенциалопределяющим ионом ставят коэффициент n.
3) Противоионы адсорбционного слоя. Ионы раствора, взятого в избытке, но не входящие в состав агрегата образуют адсорбционный слой и компенсируют заряд твердой фазы. Перед противоионом адсорбционного слоя ставят коэффициент (n-x), умноженный на численное значение заряда потенциалопределяющего иона.
Ядро и адсорбционный слой мицелы, образующие гранулу, заключают в квадратные скобки и указывают заряд гранулы — x+ или x-, умноженные на численное значение заряда потенциалопределяющего иона.
4) Противоионы диффузного слоя. Часть противоионов, находящиеся во внешней сфере мицелы, удаленной от ее ядра. Перед противоионом диффузного слоя ставят коэффициент x, умноженный на численное значение заряда потенциалопределяющего иона. Противоионы диффузного слоя записывают за квадратными скобками.
Практическое занятие №3
Тема: «Составление формул и схем строения мицелл»
Цель:
уметь по уравнению реакции составлять формулу и схему мицеллы (указывать ее составные части)
Средства обучения: таблица растворимости, конспект лекций, тестовые задания
Ход работы.
1. Выполните задание самостоятельно, в случае затруднения сверьтесь с доской.
Задание1.
К водному раствору нитрата серебра медленно приливается водный раствор хлорида натрия. Образуется коллоидный раствор. Составьте схему строения мицеллы и ответьте на вопросы.
1. какие ионы адсорбируются вокруг ядра?
А: Ag+ Б: Na+ В: Cl- Г: NO-
2. Каков заряд ядра и слоя потенциалопределяющих ионов?
А: положительный Б: отрицательный В: нейтральный
3. Какие ионы входят в состав адсорбционного слоя, являясь одновременно противоионами?
А: Ag+ Б: Na+ В: Cl- Г: NO-
4. Укажите заряд коллоидной частицы (гранулы0
А: положительный Б: отрицательный В: нейтральный
5. Какие ионы входят в состав диффузного слоя?
А: Ag+ Б: Na+ В: Cl- Г: NO-
6. Укажите заряд мицеллы
А: положительный Б: отрицательный В: нейтральный
7. К какому электроду аноду или катоду будут двигаться коллоидные частицы при элкектрофорезе?
А: к катоду Б: к аноду В: не будут передвигаться
8. Какие ионы, добавленные в раствор, могут вызвать коагуляцию?
А: Ag+ Б: Na+ В: Cl- Г: NO-
Получите у преподавателя вариант с тестовыми заданиями, выполните их на отдельном листочке и сдайте на проверку.
Перечень рекомендуемых учебных изданий, Интернет-ресурсов, дополнительной литературы
Основная литература
Аналитическая химия: учебник и практикум для СПО/Н.Г.Никитина, А.Г.Борисов, Т.И.Хаханина.- 4-е изд., перераб. и доп.-М.: Юрайт, 2018.-394 с.-https://biblio-online.ru/viewer/analiticheskaya-himiya-413450#page/1
Физическая и коллоидная химия. В.2-х ч. Ч.1 Физическая химия:: учебник для СПО/ под ред.В.Ю.Конюхова.- 2-е изд., испр., доп.-М.:Юрайт, 2018.- 259 с.-https://biblio-online.ru/viewer/fizicheskaya-i-kolloidnaya-himiya-v-2-ch-chast-1-fizicheskaya-himiya-426811#page/1
Физическая и коллоидная химия. В.2-х ч. Ч.2 Коллоидная химия:: учебник для СПО/ под ред.В.Ю.Конюхова.- 2-е изд., испр., доп.-М.:Юрайт, 2018.- 259 с- https://biblio-online.ru/viewer/fizicheskaya-i-kolloidnaya-himiya-v-2-ch-chast-2-426813#page/1
Дополнительная литература
Химия [Электронный ресурс]: учебное пособие/ — Электрон. текстовые данные.— Воронеж: Воронежский государственный архитектурно-строительный университет, ЭБС АСВ, 2015.— 92 c.— Режим доступа: http://www.iprbookshop.ru/59133.html.— ЭБС «IPRbooks»
Габриелян О.С. Естествознание. Химия: учеб. для студ. учрежд. сред. проф. образования/ О.С. Габриелян, И.Г. Остроумов.- 2-е изд., стер. – М.: Академия, 2017
Стась Н.Ф. Общая и неорганическая химия [Электронный ресурс] : справочник для СПО / Н.Ф. Стась. — Электрон. текстовые данные. — Саратов: Профобразование, 2017. — 92 c. — 978-5-4488-0022-1. — Режим доступа: http://www.iprbookshop.ru/66393.html
Органическая химия : учебник / А.И. Артеменко. — Москва : КноРус, 2018. — 528 с. — Для СПО. — ISBN 978-5-406-05331-7.- https://www.book.ru/book/924050

 Получите свидетельство
Получите свидетельство Вход
Вход



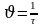

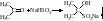
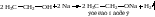
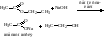









 Методические указания по выполнению лабораторных и практических занятий для студентов специальности 19.02.10 «Технология продукции общественного питания» (172.83 KB)
Методические указания по выполнению лабораторных и практических занятий для студентов специальности 19.02.10 «Технология продукции общественного питания» (172.83 KB)
 0
0 279
279 9
9 Нравится
0
Нравится
0


