
Окислительно-восстановительные реакции
(ОВР)

Основные понятия:
Степень окисления — условный заряд, который приобретает атом в результате приема или отдачи электронов с целью завершения внешнего энергетического уровня.

Основные понятия:
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается . Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается . Восстановители при этом окисляются.

Основные понятия:
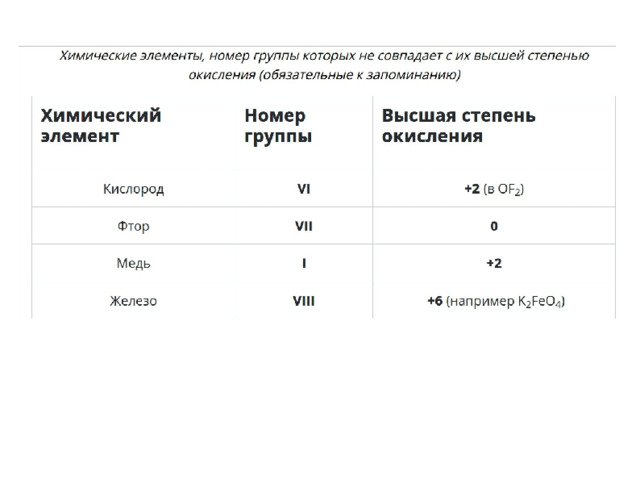
Степень окисления может быть:
- Высшая с.о. : равна номеру группы
- Низшая с.о.:
для неметаллов = № группы-8
для металлов = 0
- Промежуточная с.о.

Типичные окислители
1. F 2 , O 2 , Cl 2
2. HNO 3 и КNO 3
3. H 2 SO 4 (конц.)
4. HClO 4 , HСlO 3 , HСlO и их соли
3. KMnO 4 и K 2 MnO 4
4. K 2 CrO 4 и K 2 Cr 2 O 7
5. CrO 2 , PbO 2 , MnO 2
6. пероксиды ( К 2 О 2 ), надпероксиды (КО 2 ), озониды (КО 3 )
7. Ионы металлов, расположенных в правой части ряда напряжений: Au 3+ , Ag + .
и прочие соединения, содержащие элемент
в высшей с.о.!!!

Типичные восстановители:
1. Металлы: щелочные и щелочноземельные, Mg, Al, Zn, Sn.
2. Неметаллы: H 2 , C.
3. Гидриды металлов
4. Галогенводороды и их соли (искл. HF)
5. H 2 S и сульфиды
6. Угарный газ (CO)
7. Fe +2 , Cr +3 , Cu +1
и прочие соединения, содержащие элемент в низшей с.о.!!!

Вещества , содержащие элемент с промежуточной с.о.
могут проявлять свойства
и окислителя и восстановителя!

ОВР-переходы

На ход ОВР в растворах часто влияет СРЕДА , в которой протекает реакция: ОВ процесс между одними и теми же веществами в разных средах приводит к образованию различных продуктов.
- Для создания кислой среды обычно используют разб. H 2 SO 4 .
(HNO 3 и HCl применяют редко, т.к. первая является сильным окислителем, а вторая способна окисляться.
- Для создания щелочной среды применяют растворы KOH или NaOH

Классификация ОВР
Межмолекулярные реакции
-протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2 Al 0 + Fe +3 2 O 3 → Al +3 2 O 3 + 2Fe 0 ,

Классификация ОВР
Внутримолекулярные реакции
– это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты
2 Na N +5 O -2 3 → 2 Na N +3 O 2 + O 0 2 ↑.

Классификация ОВР
Реакции диспропорционирования
(самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3 Br 0 2 + 6 KOH → 5K Br -1 + K Br +5 O 3 + 3 H 2 O,

Классификация ОВР
Реакции диспропорционирования, которые нужно знать!
1.Все галогены, кроме F 2 , диспропорционируют в растворах всех щелочей:
- продукты при комн. температуре (на холоде)– МГ + МГО +Н 2 О;
- продукты при нагревании – МГ + МГО 3 + Н 2 О.
Пример:
Cl 2 +2KOH = KCl + KClO + H 2 O – на холоде,
3Cl 2 + 6KOH = 5KCl + KClO 3 + 3H 2 O – при нагревании,
Аналогично происходят реакции с растворами карбонатов:
Cl 2 + K 2 CO 3 = KCl + KClO + CO 2 – на холоде,
3Cl 2 + 3K 2 CO 3 = 5KCl + KClO 3 + 3CO 2 – при нагревании.

Классификация ОВР
Реакции диспропорционирования, которые нужно знать!
2. Диспропорционирование серы в растворах щелочей:
3S + 6KOH = 2K 2 S + K 2 SO 3 + 3H 2 O
или
4S + 6KOH = K 2 S 2 O 3 + 2K 2 S +3H 2 O
3. Диспропорционирование фосфора в растворах щелочей.
4P + 3KOH + 3H 2 O = PH 3 + 3KH 2 PO 2

Классификация ОВР
Реакции диспропорционирования, которые нужно знать!
4. Диспропорционирование оксида азота (IV) в воде и щелочах:
2NO 2 + H 2 O = HNO 2 + HNO 3
2NO 2 + 2NaOH = NaNO 2 + NaNO 3 + H 2 O .
5. Другие реакции диспропорционирования:
3K 2 MnO 4 + 2H 2 O = 2KMnO 4 + MnO 2 + 4KOH
4NaClO 3 = 3NaClO 4 + NaCl
4K 2 SO 3 = 3K 2 SO 4 + K 2 S
ClO 2 + H 2 O = HCl + HClO 3

Алгоритм выполнения задания № 29
1. прочитать задание
2. выбрать окислитель/восстановитель/среду
( не проглядеть реакцию диспропорционирования! )
3. составить электронный баланс
4. составить уравнение реакции:
- записать реагенты
- записать продукты
5. расставить коэффициенты

Полезные советы:
- NH 3 в качестве восстановителя в КИСЛОЙ среде выбирать не нужно, т. к. с кислотой он образует устойчивый катион аммония (NH 4 + )
- если окисл-ль или восст-ль является кислотой, то среду искать не нужно
- все соли, кроме заявленных в ОВР, и не содержащие металл в промежуточной с.о., как правило, не участвуют

 Получите свидетельство
Получите свидетельство Вход
Вход












 Окислительно-восстановительные реакции ЕГЭ (1.1 MB)
Окислительно-восстановительные реакции ЕГЭ (1.1 MB)
 0
0 318
318 16
16 Нравится
0
Нравится
0


