Тема: " Основные понятия и законы химии".
Цель: Рассмотреть основные понятия химии. Сформировать умения рассчитывать относительно молекулярную массу, количество вещества, количество частиц вещества, расставлять коэффициенты в уравнениях реакций на основе закона сохранения масс.
Ход занятия:
Орг. момент
Химия - наука о веществах, закономерностях их превращений (физических и химических свойствах) и применении. В настоящее время известно более 100 тыс. неорганических и более 4 млн. органических соединений.
Молекула - наименьшая частица вещества, обладающая его химическими свойствами. (слайд - значение символов молекулы)
Атом - наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
(слайд - строение атома, атомные массы по таблице Д.И.Менделеева)
Задание: Вычислите относительную молекулярную массу веществ (РТ+ слайд)
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль - количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Задание: Вычислите количество вещества (РТ+ слайд)
Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность - моль-1).
Задание: Вычислите количество молекул в данных веществах (РТ + слайд)
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Задание: Расставьте коэффициенты в уравнениях химических реакций. (слайд)
Закон постоянства состава
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
РТ задание 4(а,б)
Домашнее задание:
Учебное пособие: основные понятия - определения
РТ: №1 (б,г), №3,4(в)

 Получите свидетельство
Получите свидетельство Вход
Вход



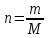
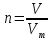
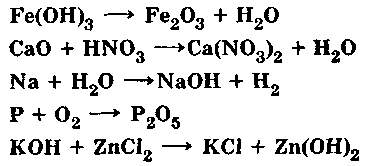









 Основные понятия химии (865.26 KB)
Основные понятия химии (865.26 KB)
 0
0 321
321 5
5 Нравится
0
Нравится
0


