Пояснительная записка
Программа предназначена для учащихся 7 класса естественнонаучного профиля. Программа данного спецкурса значительно превышает уровень расчетных задач, который предусмотрен государственным стандартом для основной школы и составлена на основании авторской адаптационной программы «Решение комбинированных и нестандартных задач по химии в классах естественнонаучного профиля» для учащихся 7-11 классов. Составитель: Иевлева И.Ф., учитель химии МБОУ г. Иркутска Гимназия № 44
Цели спецкурса:
Задачи спецкурса:
Повторение, обобщение важнейших понятий и законов химии.
Рассмотрение понятий, необходимых для проведения химических расчетов, но отсутствующих в основной программе по химии;
Совершенствование навыков использования основных алгоритмов при выполнении химических расчетов.
Решение комбинированных задач, превышающих по уровню сложности соответствующие типовые расчеты.
Программа предусматривает, в частности, решение таких достаточно сложных для средней школы задач, как исчерпывающее разнообразие расчетов с использованием основных способов выражения концентрации растворов, а также задачи по определению состава смесей, расчеты на основе электрохимического ряда напряжений металлов. При этом методика расчетов основана на максимальном использовании фундаментального понятия «моль» как количества вещества, что способствует формированию универсальных алгоритмов расчетов, успешно воспринимаемых учащимися.
Данная программа рассчитана на 34 часа, из расчета 2 часа в неделю.
содержание разделов и тем учебного курса
Введение. (10 часов)
Историческая справка развития количественных понятий в химии. Валентность. Определение валентности. Составление формул по валентности.
Расчеты с использованием основных понятий и определений химии: атом, молекула, количество вещества, структурная единица, число Авогадро.
Относительная атомная и молекулярная массы. Молярная масса. Расчет массы по известному количеству вещества.
Молярный объем газов. Расчет количества вещества по его объему. Расчет объема газа по количеству вещества. Объемная доля компонента в смеси.
Тема 1. Соотношения компонентов сложного вещества (8 часов)
Соотношения между количествами сложного вещества и составляющих его компонентов, между компонентами сложного вещества. Массовая доля элемента в веществе. Расчет массовой доли компонента в составе смеси. Определение формулы сложного вещества по известной массовой доле (по формуле и по мольным отношениям химических элементов). Массовые соотношения элементов в молекуле.
Тема 2. Расчеты по химическим уравнениям (12 часов)
Закон сохранения массы вещества и его значение.
Расчеты количества вещества, массы или объема продукта реакции (исходного вещества) по известному количеству вещества, массе или объему исходного вещества (продукта реакции) в условиях избытка одного из веществ.
Расчеты по уравнениям с участием газов.
Расчеты количества тепла и теплового эффекта реакций по термохимическим уравнениям.
Учебно-тематический план
| № п/п | Название разделов | Всего часов по рабочей программе | В том числе контрольных работ |
| 1 | Введение | 8 |
|
| 2 | Соотношение компонентов сложного вещества | 11 | 1 |
| 3 | Расчеты по химическим уравнениям | 11 | 1 |
| 4 | Обобщение по задачам за курс 7 класса | 4 | - |
|
| Всего | 34 | 2 |
*Корректировка: 1 урок выпал на праздничный день – 8.03.
Требования к уровню подготовки учащихся
Введение.
Учащиеся должны знать:
Понятие «химическая формула».
Понятия: относительная атомная масса, относительная молекулярная масса.
Способ расчета относительной молекулярной массы.
Понятие «молярная масса».
Формулу вычисления молярной массы.
Формулу вычисления молярного объема.
Формулу вычисления количества вещества по массе и объему.
Формулу вычисления числа Авогадро.
Формулу вычисления объемной доли газа в смеси.
Учащиеся должны уметь:
Составлять химические формулы по валентности.
Рассчитывать относительную молекулярную массу вещества.
Рассчитывать количество вещества по массе.
Рассчитывать молярную массу вещества по известной массе и соответствующему количеству вещества.
Рассчитывать объем газа по известной массе или количеству вещества.
Рассчитывать количество структурных единиц (атомов или молекул) в определенной массе (объеме) вещества.
Рассчитывать объем газовой смеси.
Рассчитывать объемную долю каждого компонента в газовой смеси.
Тема 1. Соотношения компонентов сложного вещества
Учащиеся должны знать:
Учащиеся должны уметь:
Вычислять массовую долю каждого элемента в молекуле;
Определять формулу вещества по известной массовой доле;
Вычислять массовую и объемную долю компонентов в смеси.
Тема 2. Расчеты по химическим уравнениям
Учащиеся должны знать:
Способ расчета по уравнениям реакций через мольные соотношения веществ.
Расчет количества вещества, объема или массы продукта реакции (исходного вещества) по известным данным об исходном веществе (продукте реакции).
Расчет количества тепла по термохимическому уравнению.
Учащиеся должны уметь:
Построить мольное соотношение веществ и пользоваться им;
Рассчитывать количество вещества, массу, объем продукта реакции (исходного вещества) по известным данным об исходном веществе (продукте реакции).
Рассчитывать количество тепла по термохимическому уравнению и составлять термохимическое уравнение.
Критерии и нормы оценки знаний, умений, навыков обучающихся
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе.
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для решения задачи и т. п.).
Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании процесса). К ним можно отнести описки, допущенные по невнимательности
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Отметка «1»:
задача не решена.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
Отметка «1»:
работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие отметки за четверть, полугодие, год.
Перечень учебно-методического обеспечения
Программы
Федеральный компонент государственного стандарта основного общего образования, одобренным совместным решением коллегии Минобразования России и Президиума РАО от 23.12.2003 г. № 21/12 и утвержденным приказом Минобрнауки РФ от 05.03.2004 г.
Гара Н.Н. Программы общеобразовательных учреждений. Химия.- М.: Просвещение, 2008.
Авторская адаптационная программа «Решение комбинированных и нестандартных задач по химии в классах естественнонаучного профиля» для учащихся 7-11 классов. Составитель: Иевлева И.Ф., учитель химии МБОУ г. Иркутска Гимназия № 44 (зарегистрирована в МОУ ЦИМПО 23.04.2009 №1546. Утверждена на заседании ГКМС протокол № 36 от 21.05.2009).
Габриэлян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений/основная школа.-М.:Дрофа, 2010.
Учебники и учебные пособия
Кузнцова Н.Е. Задачник по химии 8 класс.- М.: Вентана-Граф, 2013
Гара Н.Н. Задачник с «помощником». 8-9 классы/пособие для учащихся общеобразовательных учреждений.- М.: Просвещение, 2011
Сборник вопросов и задач по химии для общеобразовательных учреждений/подобщей редакцией А.В.Суворова.- М.: АСТ-Астрель, Санкт-Петербург: СпецЛит, 2010
Дидактический материал
Габрусева Н.И. тетрадь проверочных контрольных работ и тестов. Химия 8 класс.- М.: Экзамен, 2010.
Добротин Д.Ю., Снастина М.Г. Химия 8 класс. Контрольные работы в новом формате.- М.:Интеллект-центр, 2013.
Список литературы
Федеральный компонент государственного стандарта основного общего образования, одобренным совместным решением коллегии Минобразования России и Президиума РАО от 23.12.2003 г. № 21/12 и утвержденным приказом Минобрнауки РФ от 05.03.2004 г.
Гара Н.Н. Программы общеобразовательных учреждений. Химия.- М.: Просвещение, 2008.
Авторская адаптационная программа «Решение комбинированных и нестандартных задач по химии в классах естественнонаучного профиля» для учащихся 7-11 классов. Составитель: Иевлева И.Ф., учитель химии МБОУ г. Иркутска Гимназия № 44.
Габриэлян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений/основная школа.- М.:Дрофа, 2010.
Кузнецова Н.Е. Задачник по химии 8 класс.- М.: Вентана-Граф, 2011
Гара Н.Н. Задачник с «помощником». 8-9 классы/пособие для учащихся общеобразовательных учреждений.- М.: Просвещение, 2011
Сборник вопросов и задач по химии для общеобразовательных учреждений/под общей редакцией А.В.Суворова.- М.: АСТ-Астрель, Санкт-Петербург: СпецЛит, 2010
Габрусева Н.И. тетрадь проверочных контрольных работ и тестов. Химия 8 класс.- М.: Экзамен, 2010.
Габрусева Н.И. тетрадь проверочных контрольных работ и тестов. Химия 9 класс.- М.: Экзамен, 2010.
ГИА
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ
для спецкурса «Решение комбинированных задач по химии»
Класс 7В
Учитель И.Ф. Иевлева
Количество часов: всего 34 час, в неделю 1 час
Плановых контрольных уроков 3 , из них: контрольных работ 3 .
Планирование составлено на основе программы _ авторской адаптационной программы «Решение комбинированных и нестандартных задач по химии в классах естественнонаучного профиля» для учащихся 7-11 классов. Составитель: Иевлева И.Ф., учитель химии МБОУ г. Иркутска Гимназия № 44
Учебник Кузнецова Н.Е. – Задачник по химии 8 класс.- М.: Вентана-Граф, 2013
Кузнецова Н.Е. – Задачник по химии 9 класс.- М.: Вентана-Граф, 2013
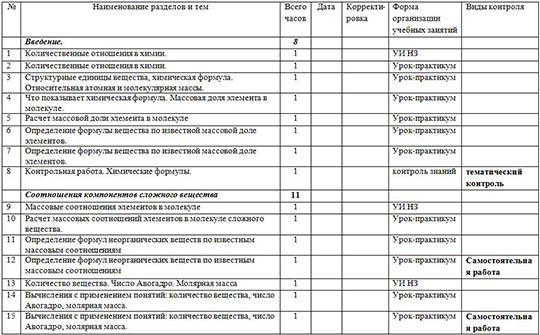
№ | Наименование разделов и тем | Всего часов | Дата -
| Корректи-ровка | Форма организации учебных занятий | Виды контроля |
-
| Введение. | 8 | -
| -
| -
| -
|
1 | Количественные отношения в химии. | 1 | -
| -
| УИ НЗ | -
|
2 | Количественные отношения в химии. | 1 | -
| -
| Урок-практикум | -
|
3 | Структурные единицы вещества, химическая формула. Относительная атомная и молекулярная массы. | 1 | -
| -
| Урок-практикум | -
|
4 | Что показывает химическая формула. Массовая доля элемента в молекуле. | 1 | -
| -
| Урок-практикум | -
|
5 | Расчет массовой доли элемента в молекуле | 1 | -
| -
| Урок-практикум | -
|
6 | Определение формулы вещества по известной массовой доле элементов. | 1 | -
| -
| Урок-практикум | -
|
7 | Определение формулы вещества по известной массовой доле элементов. | 1 | -
| -
| Урок-практикум | -
|
8 | Контрольная работа. Химические формулы. | 1 | -
| -
| контроль знаний | тематический контроль |
-
| Соотношения компонентов сложного вещества | 11 | -
| -
| -
| -
|
9 | Массовые соотношения элементов в молекуле | 1 | -
| -
| УИ НЗ | -
|
10 | Расчет массовых соотношений элементов в молекуле сложного вещества. | 1 | -
| -
| Урок-практикум | -
|
11 | Определение формул неорганических веществ по известным массовым соотношениям | 1 | -
| -
| Урок-практикум | -
|
12 | Определение формул неорганических веществ по известным массовым соотношениям | 1 | -
| -
| Урок-практикум | Самостоятельная работа |
13 | Количество вещества. Число Авогадро. Молярная масса | 1 | -
| -
| УИ НЗ | -
|
14 | Вычисления с применением понятий: количество вещества, число Авогадро, молярная масса. | 1 | -
| -
| Урок-практикум | -
|
15 | Вычисления с применением понятий: количество вещества, число Авогадро, молярная масса. | 1 | -
| -
| Урок-практикум | Самостоятельная работа |
16 | Молярный объем. | 1 | -
| -
| УИ НЗ | -
|
17 | Вычисления с применением понятий: количество вещества, молярная масса, молярный объем, число структурных единиц. | 1 | -
| -
| Урок-практикум | -
|
18 | Обобщение. Соотношение компонентов сложного вещества. | 1 | -
| -
| Урок-практикум | -
|
19 | Контрольная работа. Соотношение компонентов сложного вещества. | 1 | -
| -
| контроль знаний | тематический контроль |
-
| Расчеты по химическим уравнениям | 11 | -
| -
| -
| -
|
20 | Закон сохранения массы вещества и его значение. | 1 | -
| -
| УИ НЗ | -
|
21 | Алгоритм расчета по химическим уравнениям. | 1 | -
| -
| УИ НЗ | -
|
22 | Расчеты количества вещества, массы продукта реакции (исходного вещества) по известному количеству вещества, массе исходного вещества (продукта реакции. | 1 | -
| -
| Урок-практикум | -
|
23 | Расчеты количества вещества, массы продукта реакции (исходного вещества) по известному количеству вещества, массе исходного вещества (продукта реакции. | 1 | -
| -
| Урок-практикум | самостоятельная работа |
24 | Расчеты по уравнениям с участием газов. | 1 | -
| -
| Урок-практикум | -
|
25 | Расчеты по уравнениям с участием газов. | 1 | -
| -
| Урок-практикум | -
|
26 | -
| 1 | -
| -
| УИ НЗ | самостоятельная работа |
27 | -
| 1 | -
| -
| Урок-практикум | -
|
28 | Решение задач. Обобщение по теме «Расчеты по химическим уравнениям». | 1 | -
| -
| Урок-практикум | -
|
29 | Решение задач. Обобщение по теме «Расчеты по химическим уравнениям». | 1 | -
| -
| Урок-практикум | -
|
30 | Контрольная работа. Расчеты по химическим уравнениям | 1 | -
| -
| контроль знаний | тематический контроль |
-
| Повторение и обобщение по задачам курса 7 класса. | 3 | -
| -
| -
| -
|
31 | Решение задач. Массовая доля и массовые соотношения элементов в молекуле. | 1 | -
| -
| -
| -
|
32 | Вычисления с применением понятий: количество вещества, молярная масса, молярный объем, число структурных единиц. | 1 | -
| -
| -
| -
|
33 | Решение задач. Расчеты по химическим уравнениям. | 1 | -
| -
| -
| -
|
34 | Решение задач. Расчеты по химическим уравнениям. | -
| -
| -
| -
| -
|
-
-
-
-
-
-
-
-
-
-
-
-
-
10

 Получите свидетельство
Получите свидетельство Вход
Вход












 Программа спецкурса по химии "Решение комбинированных задач" (7 класс) (34.17 КB)
Программа спецкурса по химии "Решение комбинированных задач" (7 класс) (34.17 КB)
 0
0 1030
1030 197
197 Нравится
0
Нравится
0


