МИНИСТЕРСТВО ПРОСВЕЩЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Министерство образования Ставропольского края
муниципальное казенное общеобразовательное учреждение
«Средняя общеобразовательная школа № 15»
| РАССМОТРЕНО Руководитель МО естественно-математического цикла ________________________ Подопригора Н. В. Протокол № 1 от «_28_» августа 2023 г.
| СОГЛАСОВАНО Заместитель директора по УВР ________________________ Хашханова Д. И. Протокол № ___ от «"___"» _______ 2023 г.
| УТВЕРЖДЕНО Директор МКОУ "СОШ № 15" ________________________ Василенко О. О. Приказ № _____ от «____» ______ 2023 г.
|
Рабочая программа
по учебному курсу
« Химия»
11 класс
х. Дыдымкин 2023
Пояснительная записка
Рабочая программа по учебному курсу « Химия» для 11 класса составлена на основе Федерального государственного образовательного стандарта среднего общего образования, образовательной программы МКОУ «СОШ № 15», примерной общеобразовательной программы по химии (базовый уровень) для 11 класса.
Рабочая программа конкретизирует содержание предметных тем образовательного стандарта, дает распределение учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов учебного предмета с учетом межпредметных и внутрипредметных связей, логики учебного процесса, возрастных особенностей учащихся. В программе определен перечень демонстраций, лабораторных опытов, практических занятий и расчетных задач.
Общая характеристика учебного предмета
Основными проблемами химии являются изучение состава и строения веществ, зависимости их свойств от строения, конструирование веществ с заданными свойствами, исследование закономерностей химических превращений и путей управления ими в целях получения веществ, материалов, энергии; методы познания в химии; теоретические основы химии; неорганическая химия; органическая химия; химия и жизнь.
Цели
Изучение химии в старшей школе на базовом уровне направлено на достижение следующих целей:
освоение знаний о химической составляющей естественнонаучной картины мира, важнейших химических понятиях, законах и теориях;
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
воспитание убежденности в позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к своему здоровью и окружающей среде;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
При реализации программы используются учебники:
Габриелян О.С. Химия 11 класс (общая химия) – М: Дрофа
Место предмета в учебном плане
Программа по учебному курсу изучается в объеме 68 часов в год (2 часа в неделю)
Планируемые результаты обучения и освоения содержания курса химия для 11 класса.
Предполагается, что результатом изучения химии в 11 классе является развитие у учащихся компетентностей – социально-адаптивной (гражданственной), когнитивной (познавательной), информационно-технологической, коммуникативной.
Овладение универсальными учебными действиями значимо для социализации, мировоззренческого и духовного развития учащихся, позволяющими им ориентироваться в социуме и быть востребованными в жизни.
Личностные результаты
готовность и способность обучающихся к саморазвитию и самовоспитанию в соответствии с общечеловеческими ценностями и идеалами гражданского общества;
принятие и реализация ценностей здорового и безопасного образа жизни, бережное, ответственное и компетентное отношение к собственному физическому и психологическому здоровью;
неприятие вредных привычек: курения, употребления алкоголя, наркотиков.
уважение к своему народу, чувство ответственности перед Родиной, гордости за свой край, свою Родину, прошлое и настоящее многонационального народа России;
принятие гуманистических ценностей, осознанное, уважительное и доброжелательное отношение к другому человеку, его мнению, мировоззрению;
способность к сопереживанию и формирование позитивного отношения к людям, в том числе к лицам с ограниченными возможностями здоровья и инвалидам; бережное, ответственное и компетентное отношение к физическому и психологическому здоровью других людей, умение оказывать первую помощь;
развитие компетенций сотрудничества со сверстниками, детьми младшего возраста, взрослыми в образовательной, общественно полезной, учебно-исследовательской, проектной и других видах деятельности.
мировоззрение, соответствующее современному уровню развития науки, значимости науки, готовность к научно-техническому творчеству, владение достоверной информацией о передовых достижениях и открытиях мировой и отечественной науки, заинтересованность в научных знаниях об устройстве мира и общества;
готовность и способность к образованию, в том числе самообразованию, на протяжении всей жизни; сознательное отношение к непрерывному образованию как условию успешной профессиональной и общественной деятельности;
экологическая культура, бережное отношения к родной земле, природным богатствам России и мира; понимание влияния социально-экономических процессов на состояние природной и социальной среды, ответственность за состояние природных ресурсов; умения и навыки разумного природопользования, нетерпимое отношение к действиям, приносящим вред экологии; приобретение опыта эколого-направленной деятельности;
осознанный выбор будущей профессии как путь и способ реализации собственных жизненных планов;
потребность трудиться, уважение к труду и людям труда, трудовым достижениям, добросовестное, ответственное и творческое отношение к разным видам трудовой деятельности.
Метапредметные результаты
1. использование умений и навыков различных видов различных видов познавательной деятельности, применение основных методов познания (системно-информационный анализ, моделирование) для изучения различных сторон окружающей действительности;
2. использование основных интеллектуальных операций: формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск анализов;
3. умение генерировать идеи и определять средства, необходимые для их реализации;
4. умение определять цели и задачи деятельности, выбирать средства реализации цели и применять их на практике;
5. использование различных источников для получения химической информации, понимание зависимости содержания и формы представления информации от целей коммуникации и адресата.
Предметные результаты
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
основные теории химии: химической связи, электролитической диссоциации, строения органических соединений;
важнейшие вещества и материалы: метан, этилен, ацетилен, бензол, этанол, жиры, мыла, глюкоза, сахароза, крахмал, клетчатка, белки, искусственные и синтетические волокна, каучуки, пластмассы;
называть изученные вещества по «тривиальной» или международной номенклатуре;
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических соединений;
• объяснять: зависимость свойств веществ от их состава и строения;
• выполнять химический эксперимент по распознаванию важнейших органических веществ;
• проводить самостоятельный поиск химической информации с использованием различных источников (научно-популярных изданий, компьютерных баз данных, ресурсов Интернета); использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах;
В результате изучения учебного предмета «Химия» на уровне среднего общего образования:
Выпускник на базовом уровне научится:
раскрывать на примерах роль химии в формировании современной научной картины мира и в практической деятельности человека;
демонстрировать на примерах взаимосвязь между химией и другими естественными науками;
раскрывать на примерах положения теории химического строения А.М. Бутлерова;
понимать физический смысл Периодического закона Д.И. Менделеева и на его основе объяснять зависимость свойств химических элементов и образованных ими веществ от электронного строения атомов;
объяснять причины многообразия веществ на основе общих представлений об их составе и строении;
применять правила систематической международной номенклатуры как средства различения и идентификации веществ по их составу и строению;
составлять молекулярные и структурные формулы органических веществ как носителей информации о строении вещества, его свойствах и принадлежности к определенному классу соединений;
характеризовать органические вещества по составу, строению и свойствам, устанавливать причинно-следственные связи между данными характеристиками вещества;
приводить примеры химических реакций, раскрывающих характерные свойства типичных представителей классов органических веществ с целью их идентификации и объяснения области применения;
прогнозировать возможность протекания химических реакций на основе знаний о типах химической связи в молекулах реагентов и их реакционной способности;
использовать знания о составе, строении и химических свойствах веществ для безопасного применения в практической деятельности;
приводить примеры практического использования продуктов переработки нефти и природного газа, высокомолекулярных соединений (полиэтилена, синтетического каучука, ацетатного волокна);
проводить опыты по распознаванию органических веществ: глицерина, уксусной кислоты, непредельных жиров, глюкозы, крахмала, белков – в составе пищевых продуктов и косметических средств;
владеть правилами и приемами безопасной работы с химическими веществами и лабораторным оборудованием;
устанавливать зависимость скорости химической реакции и смещения химического равновесия от различных факторов с целью определения оптимальных условий протекания химических процессов;
приводить примеры гидролиза солей в повседневной жизни человека;
приводить примеры окислительно-восстановительных реакций в природе, производственных процессах и жизнедеятельности организмов;
приводить примеры химических реакций, раскрывающих общие химические свойства простых веществ – металлов и неметаллов;
проводить расчеты на нахождение молекулярной формулы углеводорода по продуктам сгорания и по его относительной плотности и массовым долям элементов, входящих в его состав;
владеть правилами безопасного обращения с едкими, горючими и токсичными веществами, средствами бытовой химии;
осуществлять поиск химической информации по названиям, идентификаторам, структурным формулам веществ;
критически оценивать и интерпретировать химическую информацию, содержащуюся в сообщениях средств массовой информации, ресурсах Интернета, научно-популярных статьях с точки зрения естественно-научной корректности в целях выявления ошибочных суждений и формирования собственной позиции;
представлять пути решения глобальных проблем, стоящих перед человечеством: экологических, энергетических, сырьевых, и роль химии в решении этих проблем.
Выпускник на базовом уровне получит возможность научиться:
иллюстрировать на примерах становление и эволюцию органической химии как науки на различных исторических этапах ее развития;
использовать методы научного познания при выполнении проектов и учебно-исследовательских задач по изучению свойств, способов получения и распознавания органических веществ;
объяснять природу и способы образования химической связи: ковалентной (полярной, неполярной), ионной, металлической, водородной – с целью определения химической активности веществ;
устанавливать генетическую связь между классами органических веществ для обоснования принципиальной возможности получения органических соединений заданного состава и строения;
устанавливать взаимосвязи между фактами и теорией, причиной и следствием при анализе проблемных ситуаций и обосновании принимаемых решений на основе химических знаний.
Содержание программы учебного предмета
68 часов
ПА-1
Практические работы – 2
Лабораторные опыты –16
Тема 1. Периодический закон и строение атома (6 ч)
Входная диагностическая работа
Вводный инструктаж по ТБ. Теоретические основы химии
Строение вещества. Современная модель строения атома. Электронная конфигурация атома. Основное и возбужденные состояния атомов. Классификация химических элементов (s-, p-, d-элементы). Особенности строения энергетических уровней атомов d-элементов. Периодическая система химических элементов Д.И. Менделеева. Физический смысл Периодического закона Д.И. Менделеева. Причины и закономерности изменения свойств элементов и их соединений по периодам и группам. Электронная природа химической связи. Электроотрицательность.Виды химической связи (ковалентная, ионная, металлическая, водородная) и механизмы ее образования. Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств вещества от типа кристаллической решетки. Причины многообразия веществ.
Современная модель строения атома. Ядро атома: протоны и нейтроны. Изотопы. Электроны. Электронная оболочка. Энергетический уровень. Орбитали. Электронная конфигурация атома. Распределение электронов по энергетическим уровням и орбиталям. Основное и возбужденные состояния атомов. Классификация химических элементов (s-, p-, d-элементы). Особенности строения энергетических уровней атомов d-элементов.
Периодическая система химических элементов Д.И. Менделеева. Периодическая система Д.И. Менделеева как графическое отображение Периодического закона. Различные варианты Периодической системы.
Открытие Д. И. Менделеевым Периодического закона. Периодический закон в формулировке Д.И.Менделеева. Современная формулировка Периодического закона. Физический смысл Периодического закона Д.И. Менделеева. Причины и закономерности изменения свойств элементов и их соединений по периодам и группам.
Демонстрации. Различные формы Периодической системы Д.И. Менделеева.
Тема 2. Строение вещества (20 ч)
Электронная природа химической связи. Электроотрицательность. Виды химической связи (ковалентная, ионная, металлическая, водородная) и механизмы ее образования. Понятие о ковалентной связи. Ковалентная полярная и неполярная связи. Ионная химическая связь. Катионы и анионы. Металлическая химическая связь.
Агрегатные состояния вещества. Газы. Закон Авогадро для газов. Молярный объем газообразных веществ (при н.у.). Жидкости. Минеральные воды.
Водородная связь как особый случай межмолекулярного взаимодействия. Механизм ее образования и влияние на свойства веществ. Внутримолекулярная водородная связь и ее биологическая роль.
Кристаллические и аморфные вещества. Типы кристаллических решеток (атомная, молекулярная, ионная, металлическая). Зависимость физических свойств вещества от типа кристаллической решетки. Причины многообразия веществ.
Чистые вещества и смеси. Гомогенные и гетерогенные смеси. Массовая и объемная доли компонентов в смеси. Массовая доля примесей. Растворы. Истинные растворы.
Дисперсные системы. Классификация дисперсных систем. Понятие о коллоидах (золи, гели).
Демонстрации. Модель кристаллической решетки хлорида натрия. Образцы минералов с ионной кристаллической решеткой: кальцита, галита. Модели кристаллических решеток «сухо¬го льда» (или иода), алмаза, графита (или кварца). Модель молярного объема газов. Три агрегатных состояния воды. Образцы различных дисперсных систем: эмульсий, суспензий, аэрозолей, гелей и золей.
Лабораторные опыты. 1. Определение свойств некоторых веществ на основе типа кристаллической решетки. 2.Жесткость воды. Устранение жесткости воды. 3. Ознакомление с минеральными водами. 4. Ознакомление с дисперсными системами.
Практическая работа № 1. Получение, собирание и распознавание газов.
Промежуточная диагностическая работа
Контрольная работа №1. Строение атома. Строение вещества. Химические связи.
Тема 3. Химические реакции (38 ч)
Химические реакции. Гомогенные и гетерогенные реакции. Скорость реакции, ее зависимость от различных факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, площади реакционной поверхности, наличия катализатора. Роль катализаторов в природе и промышленном производстве. Обратимость реакций. Химическое равновесие и его смещение под действием различных факторов (концентрация реагентов или продуктов реакции, давление, температура) для создания оптимальных условий протекания химических процессов. Дисперсные системы. Понятие о коллоидах (золи, гели). Истинные растворы. Реакции в растворах электролитов. рH раствора как показатель кислотности среды. Гидролиз солей. Значение гидролиза в биологических обменных процессах.Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов. Окислительно-восстановительные свойства простых веществ – металлов главных и побочных подгрупп (медь, железо) и неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния. Коррозия металлов: виды коррозии, способы защиты металлов от коррозии. Электролиз растворов и расплавов. Применение электролиза в промышленности.
Химические реакции. Классификация химических реакций по различным признакам. Реакции соединения, разложения, замещения и обмена. Гомогенные и гетерогенные реакции.
Тепловой эффект химических реакций. Экзо- и эндотермические реакции. Термохимические уравнения. Расчет количества теплоты по термохимическим уравнениям. Расчеты теплового эффекта реакции.
Скорость реакции, ее зависимость от различных факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, площади реакционной поверхности, наличия катализатора. Роль катализаторов в природе и промышленном производстве.
Обратимость реакций. Обратимые и необратимые реакции. Химическое равновесие и его смещение под действием различных факторов (концентрация реагентов или продуктов реакции, давление, температура) для создания оптимальных условий протекания химических процессов.
Теория электролитической диссоциации. Электролиты и неэлектролиты. Степень электролитической диссоциации. Сильные и слабые электролиты. Уравнения электролитической диссоциации. Реакции в растворах электролитов. рН раствора как показатель кислотности среды.
Кислоты в свете теории электролитической диссоциации. Общие свойства неорганических и органических кислот. Специфические свойства азотной, концентрированной серной и муравьиной кислот. Основания в свете теории электролитической диссоциации, их классификация и общие свойства.
Соли в свете теории электролитической диссоциации, их классификация и общие свойства. Электрохимический ряд напряжений металлов и его использование для характеристики восстановительных свойств металлов.
Гидролиз солей. Значение гидролиза в биологических обменных процессах.
Окислительно-восстановительные реакции. Окислительно-восстановительные реакции в природе, производственных процессах и жизнедеятельности организмов. Окислительно-восстановительные свойства простых веществ – металлов главных и побочных подгрупп (медь, железо) и неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния. Коррозия металлов: виды коррозии, способы защиты металлов от коррозии.
Электролиз растворов и расплавов. Применение электролиза в промышленности.
Решение задач по химическим уравнениям. Расчет массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке.
Химия в повседневной жизни. Моющие и чистящие средства. Средства борьбы с бытовыми насекомыми: репелленты, инсектициды. Средства личной гигиены и косметики. Правила безопасной работы с едкими, горючими и токсичными веществами, средствами бытовой химии.
Химия и сельское хозяйство. Минеральные и органические удобрения. Средства защиты растений.
Химия в строительстве. Цемент. Бетон. Подбор оптимальных строительных материалов в практической деятельности человека.
Химия и экология. Химическое загрязнение окружающей среды и его последствия. Охрана гидросферы, почвы, атмосферы, флоры и фауны от химического загрязнения.
Демонстрации. Экзотермические и эндотермические химические реакции. Зависимость скорости реакции от природы веществ на примере взаимодействия растворов различных кислот одинаковой концентрации с одинаковыми кусочками (гранулами) цинка и одинаковых кусочков разных металлов (магния, цинка, железа) с раствором соляной кислоты. Разложение пероксида водорода с помощью неорганических катализаторов и природных объектов, содержащих каталазу (сырое мясо, картофель). Испытание растворов электролитов и неэлектро¬литов на предмет диссоциации. Примеры реакций ионного обмена, идущих с образованием осадка, газа или воды. Химические свойства кислот: взаимодействие с металлами, основными и амфотерными оксидами, основаниями, солями. Химические свойства щелочей: реакция нейтрализации, взаимодействие с кислотными оксидами, солями. Разложение нерастворимых в воде оснований при нагревании. Химические свойства солей: взаимодействие с металлами, кислотами, щелочами, с другими солями. Гидролиз кар¬бида кальция. Изучение рН растворов гидролизующихся солей. Простейшие окислительно-восстановительные реакции: взаимодействие цинка с соляной кислотой и железа с сульфатом меди (II) .Модель электролизера.
Лабораторные опыты. 5. Реакция замещения меди железом в растворе медного купороса. 6. Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля. 7. Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля. 8.Получение водорода взаимодействием кислоты с цинком. 9. Испытание растворов кислот, оснований и солей индикаторами. 10. Ознакомление с коллекцией кислот. 11. Получение и свойства нерастворимых оснований. 12. Ознакомление с коллекцией оснований. 13. Ознакомление с коллекцией минералов, содержащих соли. 14. Ознакомление с коллекцией металлов. 15. Различные случаи гидролиза солей. щелочных металлов. 16. Ознакомление с коллекцией неметаллов.
Итоговая диагностическая работа
Практическая работа № 2. Качественные реакции на неорганические вещества и ионы.
Контрольная работа № 2 «Химические реакции».
Промежуточная аттестация (контрольная работа)
Обобщение и систематизация знаний (4 ч)
Тематический план
| Номер и название темы | Кол-во часов | Контрольные работы | Практическая часть |
| Тема 1. Периодический закон и строение атома. | 6 | Входная диагностическая работа.
| Практическая работа №1 « Получение, собирание и распознавание газов» |
| Тема2. Тема 2. Строение вещества
| 20 | КР № 1 КР№2 Промежуточная диагностическая работа. | Практическая работа № 2 « Качественные реакции на неорганические вещества и ионы» |
| Тема 3.Химические реакции | 38 | КР№3 Итоговая диагностическая работа. Промежуточная аттестация(контрольная работа) | |
Тематическое планирование
Практические работы- 2
ПА-1
Лабораторные опыты- 16
| № п/п | Тема урока | Дом.задание |
| Тема 1. Тема 1. Периодический закон и строение атома (6ч) | ||
| 1(1) | Введение. Вводный инструктаж по ТБ. Современная модель строения атома. Ядро атома. Электронная оболочка. Энергетический уровень. Особенности строения электронных оболочек атомов элементов 4-го и 5-го периодов периодической системы Д. И. Менделеева (переходных элементов). | §1., упр1-6 |
| 2 | Решение задач по теме. |
|
| 3 | Входная диагностическая работа (тестирование). Электронная конфигурация атома. Классификация химических элементов (s-, p-, d-элементы). | §1., упр.7,8
|
| 4 | Решение задач по теме. |
|
| 5 | Периодический закон Д. И. Менделеева в свете учения о строении атома. Открытие периодического закона. Периодическая система химических элементов— графическое отображение периодического закона. Физический смысл порядкового номера элемента, номера периода и номера группы. Валентные электроны. Причины изменения свойств элементов в периодах и группах (главных подгруппах). | §2, упр. 1-4, 7-9 |
| 6 | Решение задач по теме. |
|
| Тема 2. Строение вещества (20 ч) | ||
| 7 | Электронная природа химической связи. Электроотрицательность.Виды химической связи (ковалентная, ионная, металлическая, водородная) и механизмы ее образования. Ионная химическая связь. Демонстрация. Модель кристаллической решетки хлорида натрия. Образцы минералов с ионной кристаллической: кальцита, галита.
| §3, упр 1-6,9 |
| 8 | Решение задач по теме. |
|
| 9 | Ковалентная химическая связь. Электроотрицательность. Полярная и неполярная ковалентные связи. Диполь. Полярность связи и полярность молекулы. Обменный и донорно-акцепторный механизмы. Молекулярные и атомные кристаллические решетки. Свойства веществ с этими типами кристаллических решеток. Демонстрации. Модели кристаллических решеток «сухого льда» (или йода),алмаза, графита. | §4, упр 1-9 |
| 10 | Решение задач по теме. |
|
| 11 | Металлическая химическая связь. Металлическая кристаллическая решетка. Свойства веществ с этим типом связи. Лабораторный опыт №1. Определение типа кристаллической решетки вещества и описание его свойств. | §5, упр 1-6 |
| 12 | Решение задач по теме. |
|
| 13 | Водородная химическая связь. Межмолекулярная и внутримолекулярная водородная связь. Значение водородной связи для организации структур биополимеров. Демонстрация. Модели молекулы ДНК. Лабораторный опыт №2. Испытание воды на жесткость. Устранение жесткости воды. Лабораторный опыт №3 Ознакомление с минеральными водами. | §6, упр 1-6
|
| 14 | Решение задач по теме. |
|
| 15 | Агрегатные состояния вещества. Газы. Жидкости Твердое состояние вещества. | §8,упр 4, §9, упр 5, §10, упр 8 Решение задач по теме. |
| 17 | Дисперсные системы. Понятие о дисперсных системах. Дисперсная фаза и дисперсионная среда. Классификация дисперсных систем. Лабораторный опыт №4. Ознакомление с дисперсными системами. Демонстрации различных дисперсных систем: эмульсий, суспензий, аэрозолей, гелей и золей. | §11, упр 5-9 |
| 18 | Решение задач по теме. |
|
| 19 | Чистые вещества и смеси. Массовая и объемная доли компонентов в смеси. Растворы. | §12, упр. 8,9 |
| 20 | Решение задач по теме. |
|
| 21 | Практическая работа № 1 по теме «Получение, собирание и распознавание газов» |
|
| 22 | Решение задач по теме. |
|
| 23 | Промежуточная диагностическая работа (тестирование). Чистые вещества и смеси. Массовая и объемная доли компонентов в смеси. Растворы. |
|
| 24 | Решение задач по теме. |
|
| 25 | Обобщение по теме по теме «Строение атома. Строение вещества. Химические связи» |
|
| 26 | Решение задач по теме. |
|
| Тема 3. Химические реакции(19 ч ) | ||
| 27 | Понятие о химических реакциях. Реакции, идущие без изменения состава веществ. Аллотропия. Озон, его роль. Изомеры, изомерия. Реакции, идущие с изменением состава веществ. Реакции соединения, разложения, замещения и обмена. Лабораторный опыт №5. Реакция замещения меди железом в растворе медного купороса. Лабораторный опыт №6Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля | §13. упр 1-5 §14,упр 1-4 |
| 28 | Решение задач по теме. |
|
| 29 | Реакции экзо- и эндотермические. Тепловой эффект химической реакции и термохимические уравнения. Расчёты. Реакции горения, Как частный случай экзотермических реакций. Демонстрация. Получение оксида фосфора(V). | §14,упр 5-9 |
| 30 | Решение задач по теме. |
|
| 31 | Скорость химических реакций. Зависимость скорости химической реакции от природы реагирующих веществ, концентрации, температуры, площади поверхности соприкосновения и катализатора. Реакции гомо- и гетерогенные. Понятие о катализе, катализаторах. Ферменты как биологические катализаторы. Лабораторный опыт №7. Получение кислорода разложением пероксида водорода с помощью оксида марганца (IV) и каталазы сырого картофеля. Лабораторный опыт №8. Получение водорода взаимодействием кислоты с цинком | §15, упр 1-6 |
| 32 | Решение задач по теме. |
|
| 33 | Обратимость химических реакций. Необратимые и обратимые химические реакции. Химические равновесия. Способы смещения. Понятие об основных научных принципах производства на примере синтез аммиака. | §16, упр 1-5 |
| 34 | Решение задач по теме. |
|
| 35 | Роль воды в химических реакциях. Истинные растворы. Растворимость и классификация веществ по этому признаку: растворимые, малорастворимые и нерастворимые вещества. Электролиты и неэлектролиты. Электролитическая диссоциация. Демонстрация. Испытание растворов электролитов и не электролитов на предмет диссоциации | §17 |
| 36 | Решение задач по теме. |
|
| 37 | Кислоты, основания и соли с точки зрения теории электролитической диссоциации. Общие свойства неорганических и органических кислот. Лабораторный опыт № 9. Испытание растворов кислот, оснований и солей индикаторами. Лабораторный опыт № 10.Ознакомление с коллекцией кислот. | §17, §22 |
| 38 | Решение задач по теме. |
|
| 39 | Основания в свете теории электролитической диссоциации, их классификация и общие свойства. Лабораторный опыт № 11. Получение и свойства нерастворимых оснований. Лабораторный опыт № 12. Ознакомление с коллекцией оснований. | §17,§23 |
| 40 | Решение задач по теме. |
|
| 41 | Соли в свете теории электролитической диссоциации, их классификация и общие свойства. Гидролиз солей. Значение гидролиза в биологических обменных процессах. Лабораторный опыт № 13Ознакомление с коллекцией минералов, содержащих соли. | §17,§24 |
| 42 | Решение задач по теме. |
|
| 43 | Окислительно-восстановительные реакции. Степень окисления. Определение степени окисления по формуле соединения. Окисление и восстановление. | §19, упр 1,4 |
| 44 | Решение задач по теме. |
|
| 45 | Электролиз, электролиз как окислительно-восстановительный процесс. Электролиз сплавов и растворов на примере хлорида натрия. | §19, упр 5 |
| 46 | Решение задач по теме. |
|
| 47 | Окислительно-восстановительные свойства простых веществ – металлов главных и побочных подгрупп (медь, железо). Коррозия металлов: виды коррозии, способы защиты металлов от коррозии. Лабораторный опыт № 14. Ознакомление с коллекцией металлов Лабораторный опыт № 15. Различные случаи гидролиза солей. щелочных металлов. | §19, §20 |
| 48 | Решение задач по теме. |
|
| 49 | Окислительно-восстановительные свойства простых веществ – неметаллов: водорода, кислорода, галогенов, серы, азота, фосфора, углерода, кремния. Лабораторный опыт № 16. Ознакомление с коллекцией неметаллов. | §19,§21 |
| 50 | Решение задач по теме. |
|
| 51 | Решение задач по химическим уравнениям. | §19 |
| 52 | Решение задач по теме. |
|
| 53 | Практическая работа № 2 по теме «Качественные реакции на неорганические вещества и ионы» |
|
| 54 | Решение задач по теме. |
|
| 55 | Обобщение по теме: «Химические реакции» |
|
| 56 | Решение задач по теме. |
|
| 57 | Обобщение по теме: «Химические реакции» |
|
| 58 | Решение задач по теме. |
|
| 59 | Итоговая диагностическая работа (тестирование). Химия и экология. Охрана гидросферы, почвы, атмосферы, флоры и фауны от химического загрязнения. |
|
| 60 | Решение задач по теме. |
|
| 61 | Промежуточная аттестация (тестирование) |
|
| 62 | Решение задач по теме. |
|
| 63 | Химия в повседневной жизни. Правила безопасной работы с едкими, горючими и токсичными веществами, средствами бытовой химии. Химия и сельское хозяйство. Химия в строительстве. |
|
| 64 | Решение задач по теме. |
|
| Обобщение и систематизирование знаний ( 2 ч) | ||
| 65 | Повторение и обобщение изученного |
|
| 66 | Решение задач по теме. |
|
| 67 | Повторение и обобщение изученного |
|
| 68 | Решение задач по теме. |
|
Формы и способы контроля.
Контрольные работы по определенным темам.
Самостоятельные работы
Практические работы.
Лабораторные опыты.
Контрольно-обобщающие уроки.
Общественный смотр знаний.
Зачеты.
Семинары.
Тесты (подготовка к ЕГЭ)
Рефераты, доклады, работы с дополнительной литературой, справочниками, использование дидактических карточек.
Примерный перечень ученических научно-исследовательских проектов:
1. Особенности генетического ряда в органической химии .
2. Коррозия металлов и способы защиты от нее.
3. Электрический ток в химии (гальванизация, электрофорез и т.д.)
Особенности реализации рабочей программы в период дистанционного обучения
Данная рабочая программа может использоваться в период дистанционного обучения. Содержание программы остается прежним. Формы контроля образовательных результатов обучающихся с использованием электронного обучения с применением дистанционных технологий
Форы контроля:
Текущее домашнее задание: выполнение заданий по учебнику, тестирование по теме, сообщение по теме, проектная деятельность, составление презентации по теме, письменные ответы на контрольные вопросы, выполнение лабораторных и практических работ онлайн.
Промежуточная аттестация: тестирование.
Перечень учебно-методических средств обучения.
Литература для учителя:
Габриелян О. С. Химия. 11 кл. Базовый уровень. — М.: Дрофа
Габриелян О. С., Яшукова А. В. Химия. 11 кл. Базовый уровень: Методическое пособие. — М.: Дрофа
Примерные билеты и ответы по химии (подготовка к итоговой аттестации выпускников 11 класса). Дрофа, Москва
ЕГЭ. Единый государственный экзамен. Универсальные материалы для подготовки учащихся. Химия Издательство Интеллект Центр. Федеральный институт пед.измерений.
ЕГЭ Медведев Ю.Н., А.Э. Антошин, Р.А. Лидин ( 25 типов вариантов). Экзамен издательство Москва
Тесты. Т.В. Никитюк, А.М. Никитюк, И.Г. Остроумов. Для подготовки и повторения по химии. Саратов. Издательство Лицей
И.Г. Хомченко. Сборник задач и упражнений по химии для средней школы.
О.С. Габриелян, И.Г. Остроумов, А.Г. Введенская. Общая химия в тестах, задачах и упражнениях. Дрофа,
Литература для учащихся:
Габриелян О. С. Химия. 11 кл. Базовый уровень. — М.: Дрофа
Дополнительная литература для учащихся:
Примерные билеты и ответы по химии (подготовка к итоговой аттестации выпускников 11 класса). Дрофа, Москва
ЕГЭ. Единый государственный экзамен. Универсальные материалы для подготовки учащихся. Химия Издательство Интеллект Центр. Федеральный институт пед. измерений.
ЕГЭ Медведев Ю.Н., А.Э. Антошин, Р.А. Лидин (25 типов вариантов). Экзамен издательство Москва
Тесты. Т.В. Никитюк, А.М. Никитюк, И.Г. Остроумов. Для подготовки и повторения по химии. Саратов. Издательство Лицей
И.Г. Хомченко. Сборник задач и упражнений по химии для средней школы.
О.С. Габриелян, И.Г. Остроумов, А.Г. Введенская. Общая химия в тестах, задачах и упражнениях. Дрофа,
Учебно-лабораторное оборудование:
инструкция по ТБ, лабораторный штатив, спиртовка, схема строения пламени, шкаф сушильный, дистиллятор, ареометры, химические стаканы, колбы, мерные цилиндры, зажимы, пробирки, штативы для пробирок, весы, разновесы, стеклянные палочки, словари, справочники, мензурки, фарфоровые чашки, приборы для иллюстрации закона сохранения массы веществ, воронки, дугообразные трубки, капельницы, Периодическая система Менделеева, пипетки, ступки с пестиками, ерши, пластина с углублениями, тигель, ложка-дозатор, стеклянные лопаточки, аппараты Киппа, газовые приборы, асбестированные сетки, щипцы тигельные, краны соединительные, кристаллические решетки веществ, пробки с газоотводными трубками, кристаллизаторы, таблицы, пробиркодержатель, ложка для сжигания веществ, диафильмы, диапозитивы, диапроектор, коллекции, защитные очки, халаты, резиновые перчатки, термометры спиртовые, предметные столики, медаптечка, комплект мерной посуды, растворы различных веществ, магниты, индикаторы, раздаточный материал, фильтровальная бумага, прибор для испытания электропроводности растворов, озонатор, интерактивная доска, ноутбук, микролаборатория (5 штук), коллекции и др.
реактивы:металлы, неметаллы, основания, оксиды, соли, кислоты, органические вещества, пластмассы, стекло, щёлочи, огнеопасные вещества, наборы удобрений, неорганические вещества, галогениды, сульфаты, сульфиды, нитраты, индикаторы и т.д.
Технические и электронные средства обучения и контроля знаний учащихся:
Микролаборатория для химического эксперимента с электронным методическим пособием;
Баня лабораторная для ученического эксперимента;
Штатив лабораторный химический;
Прибор для получения газов лабораторный;
Набор керамики и фарфора;
Цилиндры мерные;
Бумажные фильтры 9 см;
Набор флаконов с крышками капельницами;
Штатив для пробирок;
Пробирки Флоринского;
Таблица «Периодическая система химических элементов Д.И.Менделеева»;
Таблица «Растворимость солей, кислот и оснований в воде»;
Таблица «Ряд активности металлов»;
Хранилище для химических реактивов;
Проектор короткофокусный AcerS5301WB;
Ноутбук/LNN-68851J3/LenovoE531,15.6 HD;
Приставка интерактивная MimioTeach;
МФУОК1МВ471DN
Входная диагностическая работа
1 вариант
Часть А. Тестовые задания с выбором ответа
Общая формула алканов:
А. СnН2n
Б. СnН2n + 2
В. СnН2n - 2
Г. СnН2n – 6
2. Название вещества, формула которого
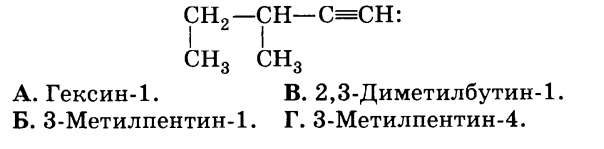
5. Вещество, для которого возможна реакция дегидратации:
А. Бутадиен – 1,3
Б. Этаналь
В. Этанол
Г. Хлорэтан
6. Окраска смеси глюкозы с гидроксидом меди я(II) при нагревании:
А. Голубая
Б. Синяя
В. Красная
Г. Фиолетовая
7. Формула реактива для распознавания глицерина:
А. Ag2O (ам.р-р)
Б. FeCl3(р-р)
В. I2 (спирт.р-р)
Г. Cu(OH)2
8. Кислота, на нейтрализацию 23 г которой расходуется 0,5 моль гидроксида калия:
А. Масляная
Б. Мупавьиная
В. Пропионовая
Г. Уксусная
Часть Б. Задания со свободным ответом.
9.Составьте уравнения реакций по приведенной схеме и укажите условия их осуществления:
1 2 3 4
СаС2 → С2H2 → С6H6 → С6H5NO2 →С6H5NН2
Дайте название каждому веществу.
10.Какую пластмассу называют целлулоидом? Как и из чего получают? Укажите недостаток этого полимера. Перечислите области применения целлулоида.
2 вариант
Часть А. Тестовые задания с выбором ответа
Общая формула алкенов:
А. СnН2n
Б. СnН2n + 2
В. СnН2n - 2
Г. СnН2n – 6
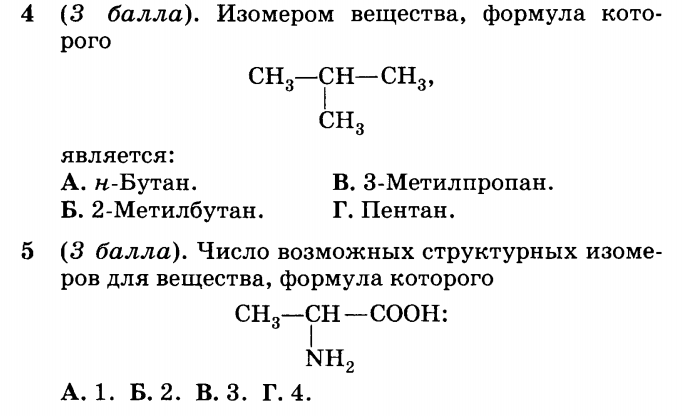
2. Название вещества, формула которого
3.Вид изомерии, характерный для алканов:
А. Положение функциональной группы.
Б. Положение кратной связи
В. Углеродный скелет
Г. Межклассовая
4. Предыдущим гомологом бутина – 1 является:
А. Бутин – 2
Б. Пентин – 1
В. Пентин – 2
Г. Пропин
5. Вещество, для которого характерна реакция полимеризации:
А. Бутадиен – 1,3
Б. Бутан
В. Бензол
Г. Бутанол - 1
6. Окраска смеси белка с гидроксидом меди (II) при нагревании:
А. Голубая
Б. Синяя
В. Красная
Г. Фиолетовая
7. Реакция для распознавания альдегидов:
А. лакмус
Б. раствор хлорида железа (III)
В. Спиртовой раствор иода
Г. Гидроксид меди (II)
8. Углеводород, 13 г которого способны присоединить 1 моль брома:
А. Ацетилен
Б. Бутадиен – 1,3
В. Бутен – 2
Г. Пропин
Часть Б. Задание со свободным ответом.
9. Составьте уравнения реакций по схеме:
1 2 3 4
С6Н12О6 → С2Н5ОН → СН3СООС2Н5 → СН3СООН→ СН2ClСООН
Укажите условия их протекания. Дайте названия веществам.
10. Почему при повышении температуры в организме человека выше 390С ферменты перестают «работать»? Что с ними при этом происходит?
Промежуточная диагностическая работа
Вариант 1
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле СО2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SiO2, CaO, Na2SO4 ; б) HClO4, CO2 ,NaBr; в) MgO. NaI, Cs2O ; г) H 2O, AlCl3, RbI.
3. Число σ-связей в молекуле этанола:
а) 6, б) 8, в) 7, г) 5.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) NH3, б) (NH4)2S, в) CCl4, г) SiF4.
5.Наибольшую электроотрицательность имеет элемент:
а) азот, б) сера, в) бром, г) кислород.
6.Степень окисления -3 фосфор проявляет в соединении:
а) P2O3, б) P2O5, в) Ca3P2 г) Ca(H2PO4)2.
7.Валентность III характерна для:
а) Ca, б) P, в) O, г) Si.
8. Все элементы в ряду могут проявлять степени окисления -1 и +5:
а) Rb, Ca, Li, б) H, Si, F, в) Cl, I, Br, г) As, N,T e.
9. Молекулярную кристаллическую решётку имеет:
а) H2S, б) NaCl, в) SiO2, г) Cu.
10. Гомологом вещества, формула которого СН2=СН-СН3, является:
а) бутан, б) бутен-1, в) бутен-2, г) бутин-1.
11. Вещество, формула которого NaHS называют:
а) сульфид натрия, б) сульфат натрия, в) гидросульфид натрия, г) гидросульфат натрия.
Часть В: Задания со свободным ответом.
В1.(3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8. Назовите эти вещества.
В2. ( 5 балла)
Какой объём кислорода потребуется для полного сгорания 1 кг этилена (этена)?
В3.( 7 баллов)
Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту равна 1,57. Определите число связей и их тип в молекуле данного вещества.
Вариант 2
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В молекуле азота N2 химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2. В каком ряду записаны вещества только с ионной связью:
а) SO2, CaO, К2SO4 ; б) H 2S, AlCl3 ,NaI; в) CO. C2H2, Cs2O ;г) CaO, BaI2,Li2O.
3. Число σ-связей в молекуле этина:
а) 5, б) 4, в) 3, г) 6.
4.Вещестао, между молекулами которого существует водородная связь:
а) этанол, б) метан, в) водород, г) бензол.
5.Наибольшая степень окисления серы в соединении:
а) KHSO3, б) Na2S, в) H2SO4,г) S8.
6.Среди элементов IVА группы наиболее электроотрицательным является:
а) Si, б) Ge, в) C г) Sn.
7.Валентность IV характерна для:
а) Ca, б) P, в) O, г) Si.
8. Все элементы в ряду могут проявлять степени окисления -3 и +5:
а) Ga , Al, Be, б) C, Se, F, в) S, In, Br, г) P, N, Sb.
9.Атомную кристаллическую решётку имеет каждое из двух веществ:
а) хлорид натрия и алмаз, б) оксид углерода и кремний,
в) алмаз и графит, г) оксид кремния (IV) и красный фосфор.
10. Изомером вещества, формула которого СН 3 -СН=СН-СН3, является:
а) бутан, б) бутин-2, в) бутен-1, г) 2- метилпропан.
11. Вещество, формула которого СН3СООNa называют:
а) гидрокарбонат натрия, б) ацетат натрия, в) формиат натрия, г) карбонат натрия.
Часть В: Задания со свободным ответом.
В1. (3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н10 О. Назовите эти вещества.
В2.(5 балла) Какая масса кислорода потребуется для полного сгорания 67,2 л (н.у.) фосфина (РН3), если в результате реакции образуется оксид фосфора (V) и вода?
В3. (7 баллов)
Найдите молекулярную формулу циклоалкана, если известно, что массовая доля углерода в нём составляет 85,71% .относительная плотность паров этого вещества по воздуху равна 1,931. Определите число связей и их тип в молекуле данного вещества.
Вариант 3
Часть А: Тестовые задания с выбором ответа.
( 2 балла за 1 правильный ответ)
1. В хлориде натрия химическая связь:
а) ионная, б) ковалентная неполярная, в) ковалентная полярная, г) водородная.
2 Соединениями с ковалентной неполярной и ионной связью являются соответственно:
а)P4 и N2O ; б) P4 и SO3; в) P4 и LiCl; г)P4 и РН3.
3. Число π-связей в молекуле серной кислоты:
а) 4, б) 2, в) 8, г) 6.
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе:
а) NH3, б) NaNO3, в) CO2, г) SiH4.
5.Наибольшую электроотрицательность имеет элемент:
а) натрий, б) литий, в) рубидий, г) калий.
6.Наибольшая степень окисления азота в соединении:
а) HNO3, б) Na3N, в) N2Oг ) N2 H4.
7.Верны ли следующие утверждения?
А. Высшая валентность элемента определяется номером группы.
Б.Высшая валентность элемента определяется номером периода.
а) верно только Б, б) верно только А
в) верны ода утверждения, г) оба утверждения неверны.
8. Все элементы в ряду могут проявлять степени окисления +7:
а) Sb, Al, Be, б) Te, Sn, F, в) Cl, I, Br, г) P, N,O.
9. Молекулярную кристаллическую решётку имеет:
а) хлорид калия, б) «сухой» лёд, в) сульфид натрия, г) чилийская селитра.
10. Изомером вещества, формула которого СН3 –СН2-СН2-ОН , является:
а) метилэтиловый эфир, б) бутанол-1, в) диметиловый эфир, г) бутанол-2.
11. Вещество, формула которого НСОН не называют:
а) формальдегид, б) метаналь , в) муравьиная кислота , г) муравьиный альдегид.
Часть В: Задания со свободным ответом.
В1. (3 балла)
Составьте структурные формулы не менее трёх возможных изомеров вещества состава С4Н8О2 . Назовите эти вещества.
В2. ( 5 балла)
Какая масса воды может быть получена при взаимодействии с кислородом 224л водорода (н.у.)?
В3( 7 баллов)
Найдите молекулярную формулу алкена, массовая доля углерода, в котором составляет 85,7%. Относительная плотность паров этого вещества по оксиду углерода (IV) равна 1,593. Определите число связей и их тип в молекуле данного вещества.
Итоговая диагностическая работа
1 Вариант
Часть I. При выполнении заданий этой части запишите одну или две буквы, которые соответствуют номеру правильного ответа.
Какое из указанных веществ имеет ионную химическую связь?
а)LiCL б) HBr в) O2 г)CO
2. Одинаковый вид химической связи имеют углекислый газ и
а) белый фосфор б) ацетилен в) кремний г) кислород
3. Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно
а) фтор и хлорид калия б) водород и хлор в) сера и водородг) вода и кислород
4. Реакциям соединения и замещения соответствуют схемы:
а)ZnO+ K2CO3и Zn + 2HCL
б) ZnO + CO2 и Zn +CuCL2
в)ZnO + Na2Oи Zn + NiCL2
г) ZnO + 2HNO3 ZnO+ Na2CO3
д) ZnSO4 + BaCL2 и ZnO+ SiO2
е) Zn + O2 и Zn +PbO
5. К каким трём из перечисленных типов реакций относится взаимодействие натрия с этанолом?
а) необратимым б) обратимым в) обмена г) замещения
д) окислительно – восстановительным е) протекающим без изменения степени окисления
6. В заданной схеме превращений ZnO→ XYZn(OH)2
веществами X и Y являются
а) Zn б) Zn3(PO4)2 в) Zn(NO3)2 г) Zn(OH)2 д) ZnCL2
7. К сокращённому ионному уравнению Ba2++ SO42- = BaSO4↓
соответствует взаимодействие хлорида бария с
а) серной кислотой б) оксидом серы (VI)
в) сульфатом натрия г) сульфидом кальция д) сульфатом серебра
8. Укажите уравнения реакций, которые используют для качественного определения серной кислоты и её солей.
а) H2SO4 + BaCL2 → BaSO4↓ + 2HCL б) HNO3 + BaSO4↓ → Ba(NO3)2 + H2SO4
в) H2SO4+ 2NaNO3 → Na2SO4 + 2HNO3 г) H2SO4 + CuS↓ → CuSO4 + H2S↑
д)Na2SO4 + Ba(NO3)2 → 2NaNO3+ BaSO4↓
9. Химическое равновесие в системе 2NO↑ + O2↑↔ 2NO2↑ + Q
смещается в сторону образования продукта реакции при
а) повышении давления б) повышении температуры
в) понижении давления г) применении катализатора
Часть II.Задания выполните письменно.
Используя метод электронного баланса определите окислитель и восстановитель
KMnO4 + HCL → MnCL2 + CL2 + KCL + H2O
Решите задачу. При сжигании 18 л органического вещества, плотность паров, которого по кислороду 1,44 образовалось 36 л оксида углерода(IV) и 43,39 гр. воды. Определите молекулярную формулу вещества.
Решите задачу. Органическое вещество, состоящее из углерода с массовой долей 32%, из водорода с массовой долей 6%, из азота с массовой долей 19% и кислорода. Относительная плотность по кислороду равна 2,35. Выведите молекулярную формулу органического вещества.
Решите задачу. К раствору серной кислоты массой 100 г прилили 104 г раствора хлорида бария с массовой долей 10% и выпавший осадок отделили фильтрованием. Для нейтрализации фильтрата потребовалось 50 мл 25% - ого раствора гидроксида натрия плотностью 1,28 г/мл. Определите массовую долю серной кислоты в исходном растворе.
2 вариант
Часть I. При выполнении заданий этой части запишите одну или две буквы, которые соответствуют номеру правильного ответа.
Веществами с ионной и ковалентной полярной связью являются соответственно
а) этилен и сульфид меди б) оксид натрия и сероводород
в) бром и водород г) сера и вода
В оксидах металлов связи
а) ионные б) ковалентные полярные в) металлические г) ковалентные неполярные
Одинаковый вид химической связи имеют бромид кальция и
а) бром б) оксид калия в) оксид азота(I) г) оксид кремния (IV)
Какие из приведённых реакций не относятся к реакциям ионного обмена?
а) Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
б) KOH + HCL → KCL + H2O
в) 2KMnO4 → K2MnO4 + MnO2 + O2↑
г) Li2SO3 + 2HNO3 → 2LiNO3 + SO2↑ + H2O
д) 2FeCL2 + CL2↑ → 2FeCL3
К каким трём из перечисленных типов реакций относится нагревание бутана в присутствии хлорида алюминия?
а) разложения б) окислительно – восстановительным
в) изомеризации г) каталитическим д) необратимым
В заданной схеме превращений Fe → FeCL3 →Fe(OH)3веществами X и Y являются
а) HCL б ) CL2 в) H2O г) CuCL2 д) NaOH е ) Cu(OH)2
7. Алкены и алкины соответственно превращаются в алканы в ходе реакции
а) гидротации б) гидрирования в) изомеризации г) дегидрирования д)гидрогалогенирования
8. Какая реакция соответствует сокращённому ионному уравнению H+ + OH- → H2O
а) ZnCL2 + 2KOH → Zn(OH)2↓ + 2KCL
б) H2SO4 + Cu(OH)2↓→ CuSO4 + 2H2O
в) 2NaOH + H2SO4 → Na2SO4 + 2H2O
г) H2SO4 + Ba(OH)2→ BaSO4↓ + 2H2O
д) 2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
10. Химическое равновесие в системе C4H10↑↔ C4H8↑ +H2↑ - Q можно сместить в сторону продуктов реакции
а) повышением температуры и повышением давления
б) повышением температуры и понижением давления
в) понижением температуры и повышением давления
г) понижением температуры и понижением давления
ПА 11 класс УК «Химия» (тестирование)
Вариант 1
Часть А (по 1 баллу)
А1. К основным оксидам относится:
оксид брома(VII); 2) оксид натрия; 3) оксид серы(IV); 4) оксид алюминия
А2. Сумма коэффициентов в уравнении реакции между оксидом алюминия и серной кислотой равна: 1) 6; 2) 8; 3) 10; 4) 12.
А3. Электрический ток проводит:
1) водный раствор глюкозы; 2) водный раствор хлорида натрия;
3) расплав серы; 4) расплав оксида кремния.
А4. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. Твердую щелочь нельзя брать руками.
Б. Чтобы определить газ по запаху, необходимо наклониться над сосудом и глубоко вдохнуть.
1) Верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
А5. Массовая доля кислорода в карбонате кальция равна: 1)15 %; 2) 27 %; 3) 48 %; 4) 54 %.
Часть В. (2 балла)
В1. Выберите уравнения реакций, в которых элемент азот является восстановителем.
1) N2 + O2 = 2NO; 2) 2NO + O2 = 2NO2;
3) N2 + 3H2 = 2NH3; 4) N2 + 3Mg = Mg3N2;
5) N2 + 6Li = 2Li3N.
Часть С ( по 3 балла)
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al → AlCl3 → X → Al2O3 → NaAlO2.
В уравнении 1 расставить коэффициенты методом электронного баланса
C2. Найти объем газа, который выделился при сжигании 10 тонн угля
ПА 11 класс УК «Химия» (тестирование)
Вариант 2
Часть А. (по 1 баллу)
А1. К кислотным оксидам относится:
1) оксид бария; 2) оксид калия; 3) оксид фосфора(V); 4) оксид меди(II).
А2. Сумма коэффициентов в уравнении реакции между кальцием и ортофосфорной кислотой равна: 1) 9; 2) 10; 3) 11; 4) 12.
А3. В ряду Se-Te-Po металлические свойства –
1) нарастают 2) не изменяются 3) ослабевают 4) изменяются периодически
А4. Практически необратимо протекает реакция ионного обмена между растворами:
1) хлорида натрия и нитрата серебра; 2) серной кислоты и нитрата натрия;
3) сульфата калия и хлорида меди(II); 4) соляной кислоты и сульфата натрия.
А5. В реакцию с раствором гидроксида натрия вступает:
1) оксид меди(II); 2) водород; 3) серебро; 4) соляная кислота.
Часть В.(2 балла)
B1. Выберите уравнения реакций, в которых элемент железо является окислителем.
1) 2Fe + 3Cl2 = 2FeCl3; 2) FeO + H2 = Fe + H2O;
3) Fe + H2O = FeO + H2; 4) Fe3O4 + 4CO = 3Fe + 4CO2;
5) 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Часть С ( по 3 балла)
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Н2S→SO2 →SO3 →X →BaSO4.
В уравнении 1 расставить коэффициенты методом электронного баланса
С2. Определить массу угля, которую необходимо сжечь, чтобы получить100 л углекислого газа.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Рабочая программа по учебному курсу « Химия» 11 класс (210.23 KB)
Рабочая программа по учебному курсу « Химия» 11 класс (210.23 KB)
 0
0 62
62 0
0 Нравится
0
Нравится
0


