
Электролитическая
диссоциация

Теория электролитической диссоциации
В Первой половине 19 века М. Фарадей ввел понятия об электролитах и неэлектролитах.
Электролитами он назвал вещества, которые проводят электрический ток.
Неэлектролитами она назвал вещества, которые не проводят электрический ток.

Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке.
Два металлических или угольных электрода помещают в раствор и соединяют с источником тока. Если раствор проводит электрический ток, то цепь замыкается, о чем свидетельствует показание вольтметра в цепи или загорание лампочки.
Схема прибора для определения электропроводности раствора: 1 - источник тока; 2 - гальванометр или лампочка; 3 - электроды; 4 - исследуемый раствор

При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток.
Дистиллированная вода

Не проводит ток и сухая поваренная соль NaCl , если в нее погрузить электроды.
Сухая соль NaCl

А вот водный раствор этой же соли проводит электрический ток. Точно так же ведут себя и другие соли, многие основания и кислоты. Например, безводные кислоты — очень плохие проводники, но водные растворы кислот хорошо проводят ток. Более того, расплавы солей и щелочей также проводят электрический ток.
Водный раствор NaCl

Электролиты- вещества, растворы и расплавы которых проводят электрический ток. Неэлектролиты- вещества, растворы и расплавы которых не проводят электрический ток.

Что называют электрическим током?
Откуда заряженные частицы берутся в растворах электролитов?

Для объяснения свойств водных растворов электролитов шведский ученый С. Аррениус (1859-1927) предложил теорию электролитической диссоциации . Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс был назван электролитической диссоциацией.

Электрический ток — упорядоченное движение заряженных частиц
Молекулы электролита в водном растворе распадаются (диссоциируют) на ионы.
Электролитическая диссоциация — распад электролита на ионы.
Ионы — заряженные частицы.
Катионы — положительные ионы.
Анионы — отрицательные ионы.

- Причина диссоциации электролита в растворе является его гидратация - взаимодействие с молекулами воды
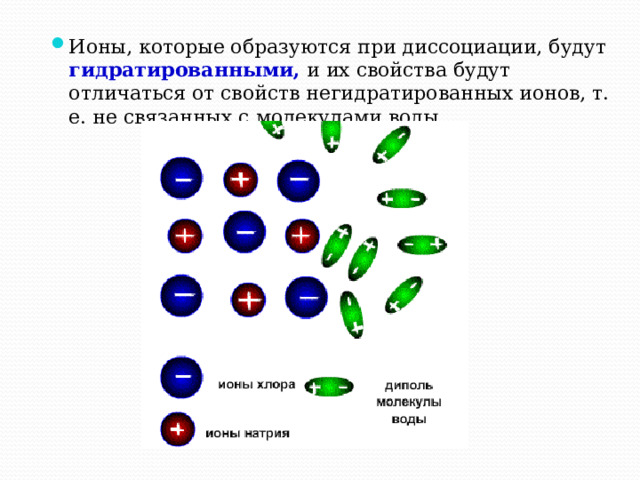
- Ионы, которые образуются при диссоциации, будут гидратированными, и их свойства будут отличаться от свойств негидратированных ионов, т. е. не связанных с молекулами воды.
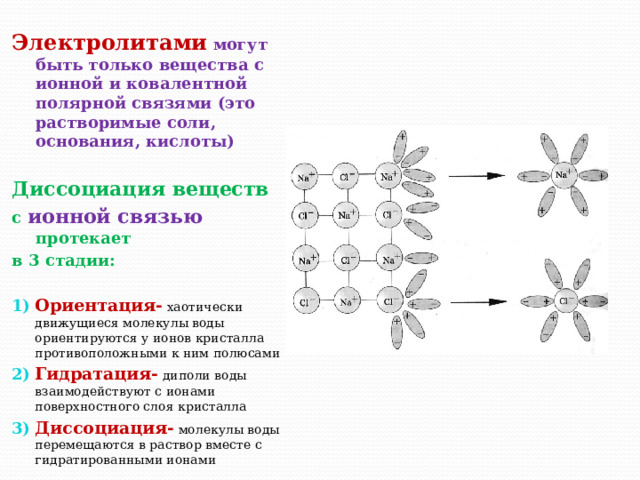
Электролитами могут быть только вещества с ионной и ковалентной полярной связями (это растворимые соли, основания, кислоты)
Диссоциация веществ
с ионной связью протекает
в 3 стадии:
- Ориентация- хаотически движущиеся молекулы воды ориентируются у ионов кристалла противоположными к ним полюсами
- Гидратация- диполи воды взаимодействуют с ионами поверхностного слоя кристалла
- Диссоциация- молекулы воды перемещаются в раствор вместе с гидратированными ионами
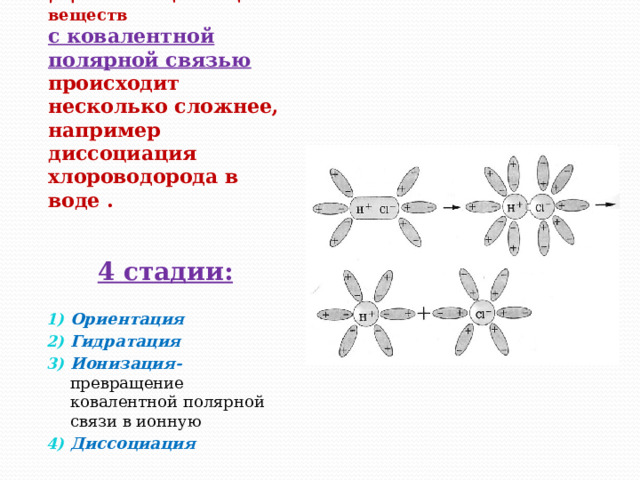
Диссоциация веществ с ковалентной полярной связью происходит несколько сложнее, например диссоциация хлороводорода в воде .
4 стадии:
- Ориентация
- Гидратация
- Ионизация- превращение ковалентной полярной связи в ионную
- Диссоциация

При расплавлении энергия, подводимая к кристаллам (например NаCl) усиливают колебания ионов в узлах кристаллической решетки, в результате чего связи между ионами разрушаются и появляются свободные ионы.


По степени диссоциации электролиты делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.

По степени диссоциации электролиты делят на сильные и слабые.
Слабые электролиты (α
1. Слабые кислоты ( H 2 S, H 2 CO 3 , HNO 2 , HClO, H 2 SiO 3 , H 3 BO 3 , H 3 PO 3 ), в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH 4 OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).

Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).

Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо . Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H 2 CO 3 ↔ H + + HCO 3 –
HCO 3 – ↔ H + + CO 3 2–

Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо . Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц.
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH) 2 ⇄ Mg(OH) + + OH –
Mg(OH) + ⇄ Mg 2+ + OH –

Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи , затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO 3 ⇄ K + + HCO 3 – (α=1)
HCO 3 – ⇄ H + + CO 3 2– (α
Mg(OH)Cl ⇄ MgOH + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α

Степень электролитической диссоциации зависит от концентрации электролита в растворе:
Чем раствор концентрированнее,
тем степень электролитической диссоциации меньше .
Чем раствор разбавленнее, тем она больше .
Степень электролитической диссоциации зависит от температуры раствора:
Степень электролитической диссоциации растёт при нагревании:
поскольку диссоциация-
процесс эндотермический, нагревание смещает равновесие вправо,
в сторону продуктов диссоциации.

Положения ТЭД Аррениуса С.
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация , т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.

Положения ТЭД Аррениуса С.
3. Под действием внешнего электрического поля положительно заряженные ионы движутся к отрицательно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны движутся к положительному электроду – аноду. Их называют анионами.

Положения ТЭД Аррениуса С.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.

Положения ТЭД Аррениуса С.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.

1. В водном растворе ступенчато диссоциирует:
1)KOH 2)CuCl 2 3)Ca(OH) 2 4)Na 2 SO 4
2. К электролитам относят все вещества ряда:
1)C2H6, Ca(OH)2 , H2S , ZnSO4
2)BaCl2, CH3OCH3, NaNO3, H2SO4
3)KOH, H3PO4, MgF2, CH3COONa
4)PbCO3, AlBr3, C12H22O11, H2SO3

3. Электрический ток проводит:
1)Спиртовой раствор йода
2) Расплав парафина
3) Расплав ацетата натрия
4)Водный раствор глюкозы
4. Электрический ток не проводит водный раствор:
1)хлорида метил- аммония
2)ацетата натрия
3) глицерина
4)муравьиной кислоты

5. Сильными электролитами являются все вещества группы:
1)KOH, HNO3, H2SO4
2)H2S, H2SO3, H2SO4
3)MgCl2, CH3COOH, NaOH
4)H2S, CH3COOH, H2SO3
6. Отметьте самый сильный электролит:
1)RbOH
2)Ca(OH)2
3)Cu(OH)2 или СuOH
4)LiOH

Реакции ионного обмена (РИО)– это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
![Правила составления РИО: На ионы мы не разбиваем: 1. Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания). (пр.Бертолле) 2. Анионы кислотных остатков кислых солей слабых кислот (НСО 3 — , Н 2 РО 4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+ 3. Комплексные катионы и анионы: [Al(OH) 4 ] —](https://fsd.videouroki.net/html/2023/10/23/v_65368133a5542/img32.jpg)
Правила составления РИО:
На ионы мы не разбиваем:
1. Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания). (пр.Бертолле)
2. Анионы кислотных остатков кислых солей слабых кислот (НСО 3 — , Н 2 РО 4 — и т.п.) и катионы основных солей слабых оснований Al(OH) 2+
3. Комплексные катионы и анионы: [Al(OH) 4 ] —

 Получите свидетельство
Получите свидетельство Вход
Вход












 Теория электролитической диссоциации ЕГЭ (1.57 MB)
Теория электролитической диссоциации ЕГЭ (1.57 MB)
 0
0 339
339 7
7 Нравится
0
Нравится
0


