Изомерия (от греческих слов «изос» – «равный» и «мерос» – «часть», «доля») — явление существования химических соединений — изомеров, — одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и по свойствам.
Термин «изомерия» вёл в химию Й. Берцелиус в 1830 году, а подлинное объяснение этот термин получил во второй половине 19 века на основе теории химического строения А. М. Бутлерова и стереохимического учения Я. Вант-Гоффа.
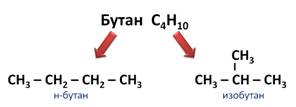
Например, вам известно, что молекулярная формула бутана – С4Н10. Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном, а бутан, цепь атомов углерода которого разветвлена, называют изобутаном. Эти два вещества имеют одинаковую молекулярную формулу, но различаются по строению, а значит, и по свойствам.
Например, молекулярной формуле C2H6O соответствуют два вещества с разными структурными формулами – этиловый спирт и диметиловый эфир. Они также имеют одинаковый состав, по разное строение и свойства. Этиловый спирт – жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,5 0С. При тех же условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -23 0С.
Существуют два основных типа изомерии. Это структурная и пространственная.
Структурные изомеры – это изомеры, имеющие различный порядок соединения атомов в молекуле.
Пространственные изомеры – это изомеры, которые имеют одинаковые заместители у каждого атома углерода, но отличаются их взаимным расположением в пространстве.
Различают три вида структурной изомерии. Это изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода, изомерию положения, обусловленную различным положением функциональных групп или кратных связей при одинаковой углеродной цепи.
Изомерия углеродного скелета характерна для любых классов органических соединений. Например, для вещества С4Н10 изомерами будут бутан и 2-метилпропан, для С5Н8 – это пентин и 3-метилбутин-1, для С5Н10О2 – это пентановая кислота и 2-метилбутановая кислота, 3-метилбутановая кислота, для С5Н12О – это пентанол-1 и 2-метилбутанол-1, для С4Н8О2 – это пропилметаноат и изопропилметаноат.
Если рассмотреть изомерию положения кратной связи или функциональной группы, то существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или функциональных групп.
Например, изомерия положения кратных связей характерна для алкенов, алкинов и диенов. Так, изомерами по отношению друг к другу будут бутен-1 и бутен-2, бутин-1 и бутин-2, бутадиен-1,2 и бутадиен-1,3. Изомерия положения функциональных групп характерна для спиртов и аминов. Так пропанол-1 и пропанол-2 будут по отношению к друг другу изомерами, как и бутанамин-1 и бутанамин-2, α-аминопропановая кислота и β-аминопропановая кислота.
В межклассовой изомерии вещества относятся к различным классам органических соединений, как этанол и диметиловый эфир имеют общую формулу – С2Н6О или бутин-1 и бутадиен-1,3, относящиеся к классам алкинов и диенов, а также этановая кислота и метилметаноат (то есть насыщенные одноосновные карбоновые кислоты и сложные эфиры).
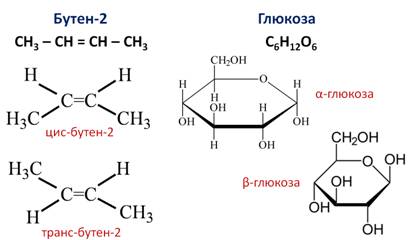
Различают два вида пространственной изомерии: геометрическую и оптическую. Геометрическая изомерия характерна для соединений с двойной углерод-углеродной связью. Так для молекулы бутена-2 характерно 2 изомера: цис-изомер и транс-изомер. У цис-изомера одинаковые группы атомов находятся по одну сторону от плоскости, а у транс-изомера – по разные стороны.
Другим примером пространственных изомеров являются циклические α- и β-формы глюкозы, различающиеся положением гидроксильных групп у первого атома углерода.
Оптической изомерией обладают только те вещества, у которых есть асимметрический, или хиральный атом (от греческого хирос – «рука», «образец несимметричной фигуры»), то есть это атом, который связан с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням и несовместимы. Так, молочная кислота, или 2-оксипропановая кислота, существует в виде двух оптических изомеров, потому что она содержит 1 асимметрический атом углерода.
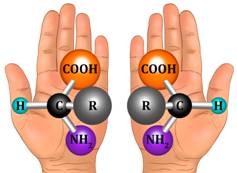
Оптическая изомерия называется также энантиомерией (от греческого enantios – «противоположный» и meros – «часть»), а оптические изомеры – энантиомерами. У хиральных молекул возникают изомерные пары, в которых молекулы изомеров различаются пространственной организацией, точно также, как предмет и его зеркальное отражение. Пара таких изомеров имеют, как правило, одинаковые химические и физические свойства, но разную оптическую активность: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой – обязательно против. Тогда один изомер называют правовращающим, а второй – левовращающим.
 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 16215
16215

