Оксиды – бинарные соединения элементов с кислородом, находящимся в степени окисления -2.
Оксиды делят на две группы: солеобразующие и несолеобразующие, или безразличные. Несолеобразующие оксиды не взаимодействуют с водой при 20 ºС, не реагируют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делят на основные, кислотные, амфотерные.

Основные оксиды образуют металлы. К основным оксидам относятся: K2O, MgO, FeO, CuO, NiO. Кислотные оксиды образуют неметаллы и металлы в степени окисления +5 и выше. Например: CO2, Cl2O7, N2O5, CrO3, Mn2O7. Амфотерные оксиды образуют металлы Be, Zn, Al, а также хром в степени окисления +3, железо в степени окисления +3, марганец в степени окисления +4 и другие. К амфотерным оксидам относятся: BeO, ZnO, Al2O3, Cr2O3, Fe2O3, MnO2.
Рассмотрим химические свойства оксидов. С водой реагируют основные оксиды с образованием щелочей, кислотные – с образованием кислот. Не реагируют с водой амфотерные оксиды, оксид кремния(IV), MgO и основные оксиды d-элементов. Например:
BaO + H2O = Ba(OH)2
K2O + H2O = 2KOH
P2O5 + 3H2O = 2H3PO4
Mn2O7 + H2O = 2HMnO4.
Оксиды реагируют между собой. Так кислотные оксиды взаимодействуют с основными, основные – с кислотными. Амфотерные оксиды реагируют с обоими типами оксидов. Во всех этих случаях образуются соли:
Na2O + CO2 = Na2CO3
K2O + Mn2O7 = 2KMnO4
ZnO + Na2O = Na2ZnO2
Al2O3 + 2SO3 = Al2(SO4)3.
Основные и амфотерные оксиды реагируют с кислотами. При этом образуется соль и вода:
CaO + 2HNO3 = Ca(NO3)2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O.
Со щелочами реагируют кислотные и амфотерные оксиды, при этом образуется соль и вода. Причём состав соли в случае амфотерных оксидов зависит от агрегатного состояния щёлочи:
CrO3 + Ba(OH)2 = BaCrO4 + H2O
ZnO + 2NaOH (т) = Na2ZnO2 + H2O
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4].
Амфотерные оксиды и оксид кремния (IV) реагирует с карбонатами. Например:
CaCO3 + SiO2 = CaSiO3 + CO2↑
Al2O3 + K2CO3 = 2KAlO2 + CO2↑.
Нужно запомнить основные способы получения оксидов и кислот. Так, оксиды можно получить при окислении простых веществ:
С + O2 = CO2
4P + 5O2 = 2P2O5.
При разложении некоторых кислот, оснований и солей также можно получить оксиды:
2Al(OH)3 = Al2O3 + 3H2O
H2SiO3 = SiO2 + H2O
CaCO3 = CaO + CO2↑.
Оксиды можно получить и при окислении сложных веществ:
CH4 + 2O2 = CO2↑ + 2H2O
2H2S + 3O2 = 2SO2↑ + 2H2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑.
В реакциях металлов и неметаллов с кислотами-окислителями также образуются оксиды. Например:
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
C + 4HNO3 = CO2↑ + 4NO2↑ + 2H2O.
Оксиды можно получить при окислении низших оксидов в высшие или при восстановлении высших оксидов:
2CO + O2 = 2CO2
CO2 + C = 2CO
Некоторые оксиды получают действием сильных кислот на соли, как например оксид углерода (IV) или оксид серы (IV):
СaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
K2SO3 + 2HNO3 = 2KNO3 + SO2↑ + H2O.
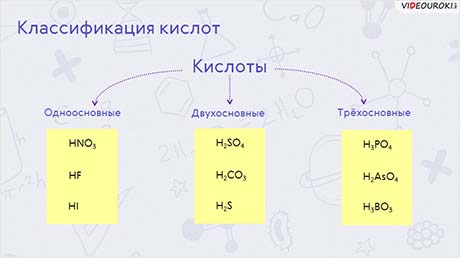
Кислоты по содержанию атомов кислорода делят на 2 группы: кислородсодержащие (оксокислоты) и бескислородные. К кислородсодержащим кислотам относятся например: HNO3, H3PO4, H2SO3. К бескислородным относятся такие кислоты, как HCl, HBr, H2S. По количеству атомов водорода в кислоте кислоты делят на одноосновные, как HNO3, HF, HI; двухосновные, как H2SO4, H2CO3, H2S; трёхосновные, как H3PO4, H2AsO4, H3BO3. По степени диссоциации кислоты делят на сильные, как HCl, H2SO4, HNO3 и слабые, как CH3COOH, H3PO4, H2SO3.
В воде кислоты диссоциируют, причём сильные – нацело. При этом образуются ионы водорода, которые изменяют окраску лакмуса и метилоранжа на красную:
HCl → H+ + Cl-
CH3COOH ↔ H+ + CH3COO-.
Кислоты реагируют с металлами, которые стоят в элетрохимическом ряду до водорода, при этом образуется соль и водород. Исключение составляет HNO3 любой концентрации, H2SO4 концентрированная, а также Pb не реагирует с концентрированной HCl, H2SO4 разбавленной, так как хлорид и сульфат свинца (II) не растворимые в воде соли.
Кислоты также реагируют с основными и амфотерными оксидами.
Например:
BaO + 2HCl = BaCl2 + H2O
ZnO + H2SO4 = ZnSO4 + H2O.
С кислотами реагируют все основания: и растворимые в воде и нерастворимые, а также амфотерные гидроксиды. Например:
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
3NaOH + H3PO4 = Na3PO4 + 3H2O
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
Кислоты реагируют с солями. Как правило, более сильная кислота вытесняет более слабую. Например:
K2CO3 + H2SO3 = K2SO3 + H2O + CO2↑
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓
KF + HCl = KCl + HF.
В отдельных случаях более слабая кислота вытесняет более сильную, или сильная вытесняет сильную, когда при этом образуется осадок:
CuSO4 + H2S = CuS↓ + H2SO4
BaCl2 + H2SO4 = BaSO4↓ + 2HCl.
Концентрированная серная кислота вытесняет из твёрдых солей все сильные кислоты. Например:
KCl (тв.) + H2SO4 (конц.) = KHSO4 + HCl↑
NaNO3 (тв.) + H2SO4 (конц.) = NaHSO4 + HNO3↑.
Кислоты также могут переводить средние соли в кислые. Например:
Na2CO3 + CO2 + H2O = 2NaHCO3.
Некоторые кислоты при нагревании разлагаются. Например:
H2CO3 = H2O + CO2↑
H2SiO3 = H2O + SiO2
H2SO3 = H2O + SO2↑
4HNO3 = 4NO2 + 2H2O + O2↑.
Следует помнить способы получения кислот. Так бескислородные кислоты можно получить растворение газа в воде.
Например:
H2 + Cl2 = 2HCl
H2 + S = H2S
H2 + Br2 = 2HBr.
Кислородсодержащие кислоты можно получить растворением в воде соответствующего оксида:
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
CO2 + H2O ↔ H2CO3.
Кислоты можно получить окислением неметаллов. Например:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO.
Кислоты получают также реакцией обмена между солью и сильной кислотой:
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3↓
AgNO3 + HCl = AgCl↓ + HNO3.
 Получите свидетельство
Получите свидетельство Вход
Вход




 548
548

