Образование химической связи в молекуле Cl2
Атом хлора находится в VIIA группе Периодической системы, значит, у него семь электронов на внешнем энергетическом уровне и ему не хватает всего одного электрона для его завершения. Шесть электронов внешнего уровня образуют пары, а один неспаренный. Два атома хлора, у которых есть по одному неспаренному электрону, сближаются, эти электроны «объединяются» и становятся общими для обоих атомов, уровень при этом становится завершенным – восьмиэлектронным. Общую пару электронов можно обозначить просто черточкой.
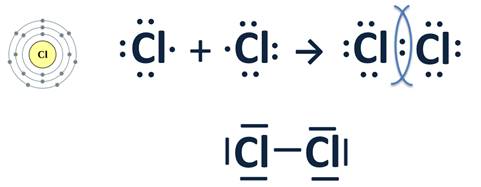
Ковалентная связь, или атомная, – это химическая связь, возникающая в результате образования общих электронных пар.
Эта химическая связь образуется между атомами одного и того же неметалла, при этом общие электронные пары, которые образовались, принадлежат обоим атомам в равной степени и ни на одном из них не будет ни избытка, ни недостатка отрицательного заряда, поэтому эта ковалентная связь называется неполярной.
Образование химической связи в молекуле Н2
Аналогично, образуется и молекула Н2. Однако атом водорода находится в IA группе, поэтому у каждого атома водорода только один электрон и до завершения внешнего энергетического уровня ему не хватает всего одного электрона (для атомов водорода и гелия уровень считается завершенным, если на нем 2 электрона). Каждый атом водорода имеет по одному электрону и эти неспаренные электроны объединяются, образуя общую электронную пару, которую также можно обозначить в виде черточки.
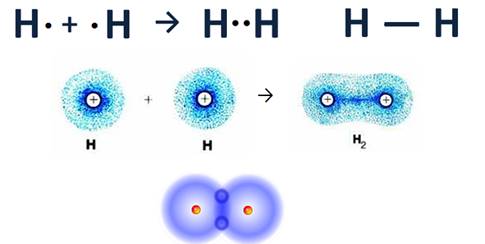
Кроме того, при сближении двух атомов водорода, каждый из которых имеет по одному s-электронному облаку сферической формы, происходит перекрывание этих электронных облаков. При этом образуется область, где плотность отрицательного заряда велика, положительно заряженные ядра притягиваются к ней, и образуется молекула.
Механизм образования более сложной молекулы О2
Кислород находится в VIA группе, следовательно, у него 6 электронов на внешнем уровне. А для того чтобы определить число неспаренных электронов, можно использовать формулу 8 – N, где N – номер группы. Поэтому у каждого атома кислорода будет по 2 неспаренных электрона, которые и будут участвовать в образовании химической связи. Эти два неспаренных электрона объединяются с двумя другими неспаренными электронами другого атома и образуется две общие электронные пары, что условно можно изобразить в виде двух чёрточек.
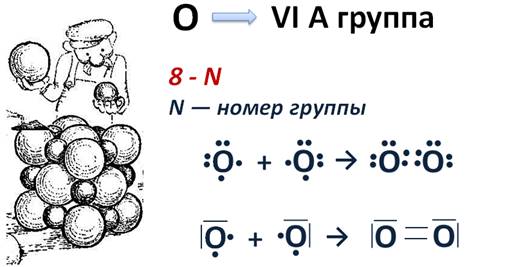
Так как, связь в молекуле кислорода состоит из двух электронных пар, ее называют еще двойной, она будет буде более прочной, чем одинарная, как в молекуле водорода. Чем прочнее связь между атомами в молекуле, тем меньше расстояние между ядрами атомов. Это расстояние называется длиной связи. Тройная связь еще короче двойной, но гораздо прочнее. Например, в молекуле азота тройная связь, для того чтобы разделить молекулу на два атома необходимо затратить в семь раз больше энергии, чем для разрыва одинарной связи в молекуле хлора.
Длина связи


 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 15719
15719

