К концу 18 века широкое распространение в химии получила кислородная теория окисления. Согласно этой теории окисление – это процесс соединения вещества с кислородом, а восстановление – это процесс отнятия у него кислорода. Согласно данной теории в химических реакциях, протекающих с изменением степеней окисления атомов, происходит передача электронов от одних частиц к другим. Такими частицами могут быть атомы, ионы.
Окислительно-восстановительные процессы лежат в основе многих явлений природы, в основе промышленных производств, без них невозможна жизнедеятельность человека, животных и растений.
Все химические реакции можно разделить на два типа. Это реакции, которые протекают без изменения степени окисления, то есть степени окисления всех элементов в молекулах исходных веществ равны степеням окисления этих элементов в молекулах продуктов реакции. Так, в реакции серной кислоты с гидроксидом калия степени окисления элементов в исходных веществах равны степеням окисления этих элементов в продуктах реакции.
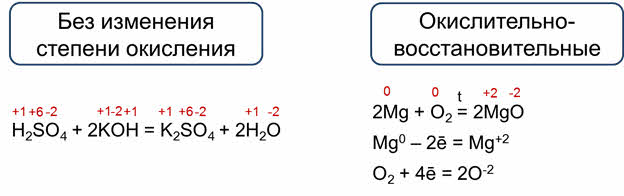
Реакции, которые идут с изменением степеней окисления элементов являются окислительно-восстановительными. То есть, степени окисления всех или некоторых элементов в молекулах исходных веществ не равны степеням окисления этих элементов в молекулах продуктов реакции.
Так, в реакции магния с кислородом магний и кислород изменяют свои степени окисления: магний с нуля до плюс двух, а кислород с нуля до минус двух.
Изменение степеней окисления в ходе окислительно-восстановительных реакций обусловлено полным или частичным переходом электронов от атомов одного элемента к атомам другого элемента. В данной реакции каждый атом магния отдаёт два электрона и эти электроны переходят к молекуле кислорода. Каждый атом кислорода в молекуле кислорода присоединяет два электрона, поэтому молекула кислорода присоединяет четыре электрона.
Окислительно-восстановительными являются реакции железа с хлором, потому что железо изменяет свою степень окисления с нуля до плюс трёх, а хлор – с нуля до минус единицы.
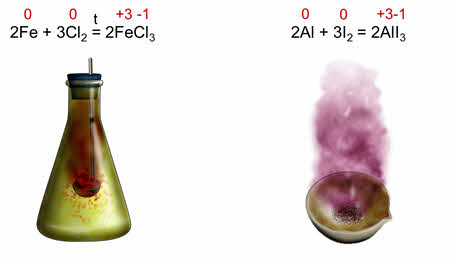
Окислительно-восстановительной является и реакция алюминия с йодом, здесь алюминий изменяет свою степень окисления с нуля до плюс трёх, а йод – с нуля до минус единицы.
Рассмотрим реакцию взаимодействия перманганата калия с соляной кислотой.
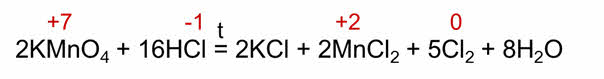
В этой реакции атомы хлора, которые в молекуле аш-хлор имеют степень окисления минус один, отдают по одному электрону и превращаются в нейтральные атомы хлора. А атом марганца, который в перманганате калия имеет степень окисления плюс семь, присоединяет пять электронов и превращается в атом марганца со степенью окисления плюс два.
Таким образом, любая окислительно-восстановительная реакция представляет собой совокупность процессов отдачи и присоединения электронов.
Процесс отдачи электронов называется окислением. В результате процесса окисления степень окисления элемента повышается.
Процесс присоединения электронов называется восстановлением. В результате процесса восстановления степень окисления понижается.
Таким образом, атомы, молекулы или ионы, которые отдают электроны, называются восстановителями. Частицы, которые присоединяют электроны, называются окислителями.
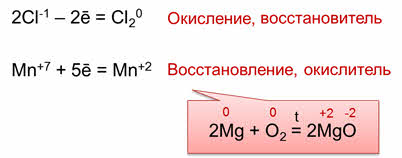
Поэтому, в рассмотренных реакциях восстановителями являются магний и соляная кислота, а окислителями – кислород и перманганат калия. Восстановитель участвует в процессе окисления, то есть окисляется, а окислитель участвует в процессе восстановления, то есть восстанавливается.
Какие же вещества могут быть окислителями, а какие восстановителями? Если в состав вещества входит элемент с высшей степенью окисления, то он может только понижать степень окисления, то есть участвовать в процессе восстановления и это вещество может быть только окислителем.
Только окислителем может быть: перманганат калия, так как марганец здесь в высшей степени окисления – плюс семь. Если в состав вещества входит элемент с низшей степенью окисления, то он может только повышать её, то есть участвовать в процессе окисления, и это вещество может выступать только в роли восстановителя.
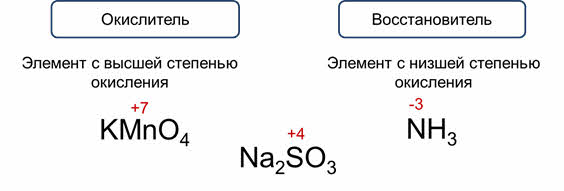
Так, в аммиаке степень окисления азота минус три, а это для него низшая степень окисления.
Если в состав вещества входит элемент с промежуточной степенью окисления, то он может повышать и понижать её, то есть может участвовать в процессах и окисления, и восстановления. Это вещество в данном случае может быть и окислителем, и восстановителем.
Так, в сульфите натрия степень окисления серы плюс четыре, а это промежуточная степень окисления. Будет сульфит натрия окислителем или восстановителем зависит от другого участника реакции.
Так, в реакции с перманганатом калия сульфит натрия является восстановителем, так как сера повышает свою степень окисления до плюс шести, а в реакции с сероводородом, сера понижает свою степень окисления и выступает в роли окислителя.
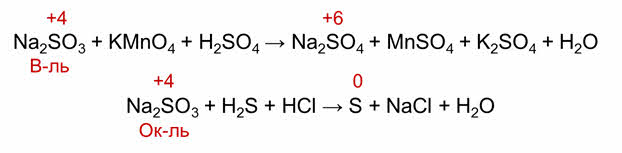
Следовательно, важнейшими окислителями являются простые вещества-неметаллы с наибольшими значениями электроотрицательности: фтор, кислород.
К важнейшим окислителям относятся также сложные вещества, которые содержат элементы в высшей степени окисления: перманганат калия, бихромат калия, азотная кислота и её соли, концентрированная серная кислота, оксид свинца четыре, хлорная кислота и её соли.
Окислительные свойства кислорода в пероксидах нашли своё применение при отбеливании тканей, бумаги. В присутствии перекисли водорода сульфид свинца два переходит в сульфат свинца два, эта реакция используется при реставрации картин.
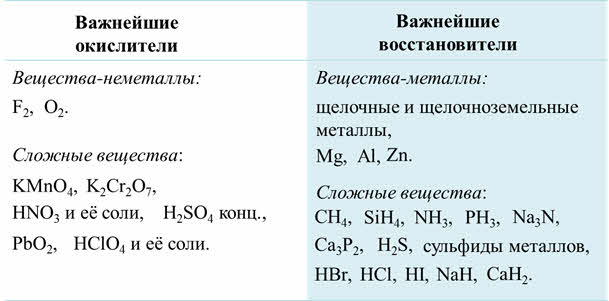
Важнейшими восстановителями являются простые вещества-металлы, например, щелочные и щелочноземельные металлы, магний, алюминий, цинк. К важнейшим восстановителям относятся также сложные вещества, которые содержат элементы в низшей степени окисления, как метан, силан, аммиак, фосфин, нитриды и фосфиды металлов, сероводород и сульфиды металлов, бромоводород, хлороводород, йодоводород и галогениды металлов, а также гидриды металлов.
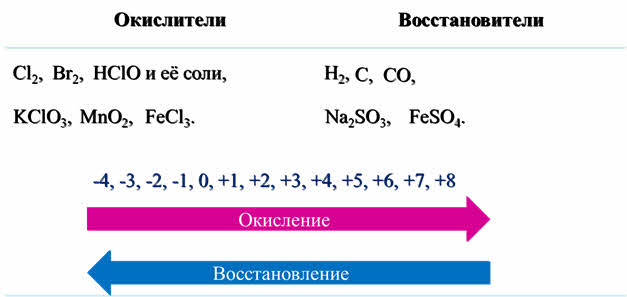
Среди веществ, содержащих элементы в промежуточной степени окисления, есть вещества, для которых характерны или окислительные, или восстановительные свойства.
Так, окислителями обычно являются хлор, бром, хлорноватистая кислота и её соли, хлораты, оксид марганца четыре, соли трёхвалентного железа.
А в роли восстановителей чаще всего выступают водород, углерод, оксид углерода два, сульфиты металлов, соли двухвалентного железа.
Различают три типа окислительно-восстановительных реакций.
Это межмолекулярные окислительно-восстановительные реакции, в которых окислитель и восстановитель входит в состав различных веществ. Например, в реакции хлорида железа три с йодидом калия окислитель и восстановитель входит в состав различных веществ. Железо – окислитель входит в состав хлорида железа три, а йод – восстановитель, входит в состав йодида калия.
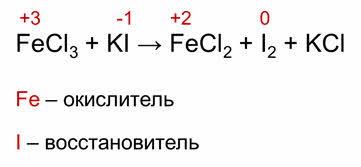
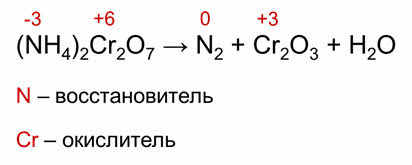
К внутримолекулярным окислительно-восстановительным реакциям относятся реакции, в которых окислитель и восстановитель входит в состав одного вещества. К этому типу реакций относится большинство реакций разложения. Так, в реакции разложения бихромата аммония элемент-окислитель и элемент-восстановитель находится в одном веществе. Так, азот является восстановителем в составе бихромата аммония, а хром является окислителем, также в составе бихромата аммония.
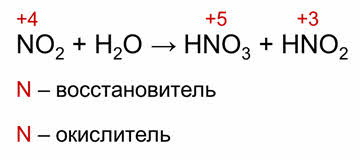
К реакциям самоокисления-самовосстановления, или диспропорционирования, относятся реакции, в которых один и тот же элемент и окисляется, и восстанавливается. Так, в реакции оксида азота пять с водой азот и повышает свою степень окисления до плюс пяти и понижает до плюс трёх, то есть он и окисляется, и восстанавливается.
Для того чтобы составить уравнения окислительно-восстановительных реакций необходимо соблюдать следующую последовательность:
· Записать схему химической реакции;
· Расставить степени окисления атомов элементов; выделить элементы, которые изменили свои степени окисления, определить окислитель и восстановитель;
· Определить число отданных и принятых электронов, составить электронный баланс;
· Подобрать коэффициэнты в уравнении реакции.
Расставим коэффициенты в уравнении реакции сероводорода с кислородом. Сначала записываем схему химической реакции.
Расставляем степени окисления, выделяем элементы, которые изменили степени окисления, у нас – это сера и кислород.
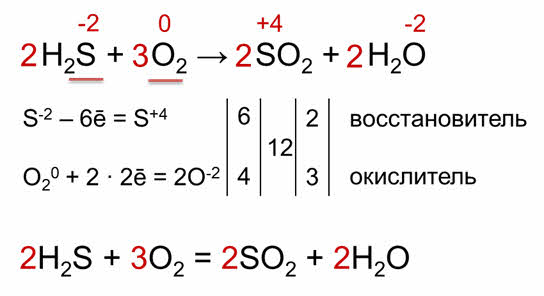
Затем определяем число электронов, приобретенных атомами кислорода и отданных атомами серы. Так сера отдает шесть электронов, а кислород принимает четыре электрона. Следовательно, сера – восстановитель, а кислород – окислитель.
Для того чтобы уравнять число отданных и принятых электронов, находим наименьшее кратное этих чисел, то есть это 12, 12 делим на 6 будет 2, 12 делим на 4 будет 3. Результаты деления и будут коэффициенты в уравнении реакции. Переносим эти коэффициэнты в левую часть схемы химической реакции, а число атомов водорода, которые не участвовали в окислительно-восстановительном процессе, уравниваем подбором. Теперь вместо стрелки можно поставить знак равенства между исходными веществами и продуктами реакции.
В реакциях металлов с некоторыми кислотами коэффициэнты расставляются иначе. Запишем схему химической реакции магния с разбавленной азотной кислотой.
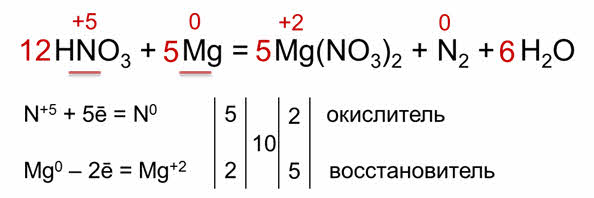
Расставляем степени окисления элементов, магний и азот изменили свои степени окисления. Определяем число отданных и присоединённых электронов. Так, азот присоединяет пять электронов, а магний отдаёт два электрона. Азот – окислитель, а магний – восстановитель.
Находим наименьшее общее кратно – десять. 10 делим на 5 будет 2, десять делим на 2 будет 5. Переносим полученные коэффициэнты в схему реакции. На связывание пяти моль ионов магния необходимо 10 моль нитрат-ионов, то есть дополнительно 10 моль азотной кислоты, кроме тех двух молей, которые пошли на окисление магния. Следовательно, в левой части уравнения перед формулой азотной кислоты нужно поставить коэффициэнт 12. Остаётся подсчитать число атомов кислорода до реакции, оно равно 36, значит перед формулой воды нужно поставить коэффициэнт шесть, потому что в нитрате магния 30 атомов кислорода.
В некоторых окислительно-восстановительных реакциях более двух элементов изменяют свои степени окисления. В реакции сульфида фосфора три с азотной кислотой фосфор, сера и азот изменяют свои степени окисления. Фосфор отдаёт 4 электрона, сера – 18, а азот принимает 1 электрон.
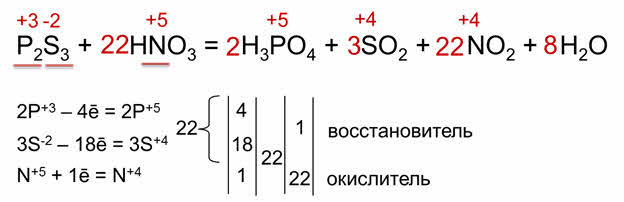
Таким образом, фосфор и сера являются восстановителями, а азот – окислителем. Следовательно, складываем число электронов, отданных восстановителями, получается 22 электрона. Для того чтобы сбалансировать число электронов, находим наименьшее общее кратное – 22. Делим 22 на 22 получаем 1, 22 делим на 1 получаем 22. Переносим полученные коэффициэнты в схему химической реакции.
Уравниваем число атомов фосфора и серы до и после реакции, в последнюю очередь считаем число атомов кислорода. До реакции 66 атомов кислорода, значит, перед формулой воды следует поставить коэффициент 8.
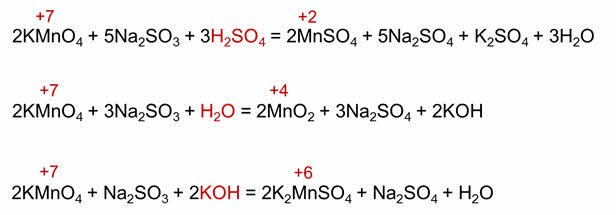
Изменяя пэ-аш среды можно изменить продукт реакции. Так, в кислой среде перманганат калия восстанавливается до марганца со степенью окисления плюс два, в нейтральной среде – до оксида марганца четыре (пауза), а в щелочной – до марганат-иона.
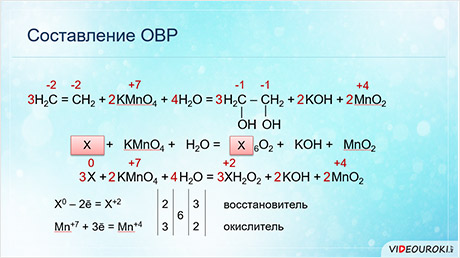
Для органических реакций коэффициэнты расставляются аналогично. Запишем схему реакции окисления этилена до этиленгликоля.
Определяем степени окисления атомов элементов, учитывая, что электроотрицательность атома углерода больше чем атома водорода, но меньше, чем кислорода. Так, в этилене степень окисления углерода минус два, а в этиленгликоле минус один, марганец также меняет свою степень окисления с плюс семи до плюс четырёх. Углерод отдаёт два электрона, а марганец принимает 3 электрона.
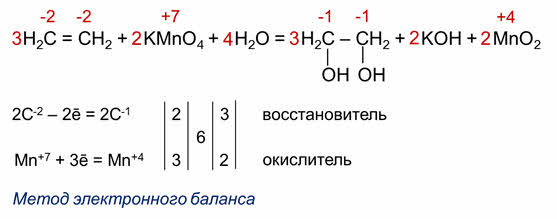
Следовательно, углерод – восстановитель, а марганец – окислитель. Находим наименьшее кратное – шесть. 6 делим на 2 будет 3, шесть делим на 3 будет 2. Полученные коэффициэнты переносим в схему реакции. Считаем атомы кислорода в продуктах реакции – 12. Следовательно, перед формулой воды следует поставить коэффициэнт 4.
Этот метод уравнивания окислительно-восстановительных реакций называется методом электронного баланса.
В органической химии кроме этого метода удобно использовать метод макроподстановки. Разберём этот метод на примере предыдущей реакции.
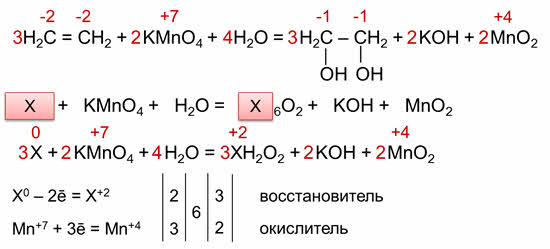
Выделим общий фрагмент в молекулярной формуле исходного органического вещества и продукта. В нашем случае это фрагмент цэ-два-аш-четыре, который мы обозначим за икс.
Перепишем исходную схему реакции в упрощённом виде, а затем расставляем степени окисления. Икс изменяет свою степень окисления и марганец. Икс отдаёт 2 электрона и повышает свою степень окисления до плюс двух, а марганец принимает 3 электрона и понижает степень окисления до плюс четырёх.
Находим также наименьшее общее кратное, которое делим на число отданных и принятых электронов и получаем соответствующие коэффициэнты, которые переносим в схему реакции.
В последнюю очередь уравниваем кислород. Полученные таким образом коэффициэнты можно перенести в исходное уравнение реакции.
Окислительно-восстановительные реакции являются самыми распространёнными в природе и на производстве. В природе – это дыхание и обмен веществ во всех живых организмах, фотосинтез, брожение, гниение. В промышленности их применяют при получении металлов, аммиака, кислот, при изготовлении фотографий. В повседневной жизни мы также встречаемся с окислительно-восстановительными процессами: ржавление железа, горение природного газа, потемнение серебряных изделий.

 Получите свидетельство
Получите свидетельство Вход
Вход




 8138
8138

