В 4-ом периоде к металлам В-групп относятся скандий Sc, титан Ti, ванадий V, хром Cr, марганец Mn, железо Fe, кобальт Co, никель Ni, медь Cu, цинк Zn. Эти все металлы являются элементами d-семейства.
У металлов В-групп есть особенность, которая заключается в том, что электронами заполняется не внешний, а предвнешний (3d-подуровень). Причём для некоторых элементов характерен, так называемый «проскок» электрона. Как для скандия Sc, титана Ti, хрома Cr и меди Cu.
Для элементов В-групп характерны и переменные степени окисления в соединениях. Например, для ванадия V: +2, +3, +4, +5; для хрома Cr: +2, +3, +6; для марганца Mn: +2, +3, +4, +6, +7; для железа Fe: +2, +3, +6.
Для металлов В-групп характерны высокие температуры плавления и кипения, твёрдость, большая плотность. Они могут образовывать основные, амфотерные и кислотные оксиды и гидроксиды. Причём, чем выше степень окисления металла в оксиде или гидроксиде, тем сильнее выражены у соединения кислотные свойства.
Например, к основным оксидам и гидроксидам относятся: Sc2O3, Sc(OH)3, CuO, Cu(OH)2, FeO, Fe(OH)2, CoO, Co(OH)2, NiO, Ni(OH)2, CrO, Cr(OH)2, MnO, Mn(OH)2. К амфотерным оксидам и гидроксидам относятся: Fe2O3, Fe(OH)3, MnO2, Mn(OH)4, Cr2O3, Cr(OH)3, Mn2O3, Mn(OH)3, ZnO, Zn(OH)2. К кислотным оксидам и гидроксидам относятся: Mn2O7, HMnO4, CrO3, H2CrO4, H2Cr2O7.
Железо – блестящий серебристо-белый металл, тяжёлый и тугоплавкий, занимает второе место среди металлов по распространённости в земной коре.
В промышленности его получают в доменном процессе по такой схеме: сначала из оксида железа (III) получают железную окалину, из неё – оксид железа (II), из которого получают железо:
Fe2O3 → Fe3O4 → FeO → Fe.
В лаборатории железо можно получить из оксида железа (III), причём восстановителями в данном случае являются водород или алюминий:
Fe2O3 + 3H2 = 2Fe + 3H2O↑
Fe2O3 + 2Al = 2Fe + Al2O3.
Рассмотрим химические свойства железа. Железо реагирует с кислородом при нагревании, при этом образуется железная окалина; в реакции железа с углеродом образуется карбид железа; в реакции железа с серой образуется сульфид железа (II); в реакции железа с хлором образуется хлорид железа (III). При нагревании железо реагирует с парами воды с образованием железной окалины и водорода; в реакции железа с кислотами и разбавленной серной кислотой образуются соли и водород. Например, в реакции железа с разбавленной серной кислотой образуются сульфат железа (II) и водород; с концентрированной азотной и серной кислотами железо при обычных условиях не реагирует (HNO3 (конц.), H2SO4 (конц.)). Железо реагирует с растворами солей, например в реакции железа с раствором сульфата меди (II) образуются сульфат железа (II) и медь.

У железа есть несколько оксидов. Оксид железа (II) – FeO – основный оксид, в воде нерастворим, но растворим в сильных кислотах. Так, в реакции оксида железа (II) с соляной кислотой образуются хлорид железа (II) и вода:
FeO + 2HCl = FeCl2 + H2O.
Его получают разложением гидроксида железа (II) или оксалата железа (II) в инертной атмосфере:
Fe(OH)2 = FeO + H2O
FeC2O4 = FeO + CO + CO2↑.
Этому оксиду железа (II) соответствует основание – гидроксид железа (II) – Fe(OH)2. Это – основный гидроксид, слабое основание, в воде не растворяется, но растворяется в сильных кислотах. Так, в реакции гидроксида железа (II) с серной кислотой образуются сульфат железа (II) и вода:
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O.
Соединения железа (II) обладают восстановительными свойствами. Например, в реакции хлорида железа (II) с хлором образуется хлорид железа (III). В реакции гидроксида железа (II) с кислородом и водой образуется гидроксид железа (III):
2FeCl2 + Cl2 = 2FeCl3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Ионы Fe2+ обнаруживаются с помощью красной кровной соли K3[Fe(CN)6], а ионы Fe3+ обнаруживаются с помощью жёлтой кровяной соли, но в том и другом случае выпадают осадки синего цвета:
3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓
4Fe3+ + 3[Fe(CN)6]4- = Fe4[Fe(CN)6]3↓.
Соединения железа (III) обладают окислительными свойствами. Так, в реакции хлорида железа (III) с железом образуется хлорид железа (II):
2FeCl3 + Fe = 3FeCl2.
Следует запомнить реакцию солей трёхвалентного железа с медью. В результате этой реакции образуются соли двухвалентных катионов. Так, в реакции хлорида железа (III) с медью образуются хлорид меди (II) и хлорид железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2.
Смешанный оксид железа Fe3O4 можно рассматривать как смесь оксидов FeO ∙ Fe2O3. При взаимодействии этого оксида с кислотами-неокислителями происходит образование двух солей. Например, в реакции смешанного оксида с соляной кислотой образуются хлорид железа (II), хлорид железа (III) и вода:
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O.
В реакции смешанного оксида с кислотами-окислителями образуются соли железа (III). Например, в реакции этого оксида с концентрированной серной кислотой образуются сульфат железа (III), оксид серы (IV) и вода:
2Fe3O4 + 10H2SO4 (конц.) = 3Fe2(SO4)3 + SO2↑ + 10H2O.
Хром – тугоплавкий блестящий металл, обладает высокой твёрдостью и царапает стекло. Чистый хром пластичен, но в присутствии даже незначительных примесей кислорода, азота и углерода становится хрупким и при ударе молотком легко раскалывается.
Соединения двухвалентного хрома можно получить при растворении металлического хрома в кислотах-неокислителях или восстановлением солей хрома (III) в кислой среде металлическим цинком. Так, в реакции хрома с соляной кислотой образуются хлорид хрома (II) и вода; в реакции хлорида хрома (III) цинком в кислой среде образуются хлорид хрома (II) и хлорид цинка:
Cr + 2HCl = CrCl2 + H2↑
2CrCl3 + Zn = 2CrCl2 + ZnCl2.
Гидроксид хрома (II) проявляет основные свойства, поэтому он реагирует с кислотами. Так, в реакции гидроксида хрома (II) c соляной кислотой образуются хлорид хрома (II) и вода:
Cr(OH)2 + 2HCl = CrCl2 + 2H2O
Получают гидроксид хрома (II) реакцией растворимой соли двухвалентного хрома со щёлочью:
CrCl2 + 2NaOH = Cr(OH)2↓ + 2NaCl.
Реакции окисления хрома до высшей степени окисления проводят в щелочных растворах и расплавах. Например, в реакции гидроксида хрома (III) с твёрдым хлоратом натрия в присутствии гидроксида натрия образуются хромат натрия, хлорид натрия и вода:
2Cr(OH)3 + NaClO3 (тв.) + 4NaOH (тв.) = 2Na2CrO4 + NaCl + 5H2O.
В водном растворе хром до высшей степени окисления можно окислить хлором, бромом, гипохлоритом натрия или перекисью водорода. Например, в реакции гидроксида хрома (III) хлором в присутствии гидроксида калия образуются хромат калия, хлорид калия и вода:
2Cr(OH)3 + 3Cl2 + 10 KOH = 2K2CrO4 + 6KCl + 8H2O.
Высшей степени окисления в водном растворе соответствуют хромат и дихромат-анионы. Хромат-ион придаёт раствору ярко-жёлтую окраску, а дихромат-ионы придают раствору оранжевую окраску. Чтобы из хромат-иона получить дихромат-ион, нужно к храмат-иону добавить кислоту. А для того, чтобы из дихромат-иона получить хромат-ион, нужно к дихромат-иону добавить щёлочь:
2Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 2NaOH = 2Na2CrO4 + H2O.
Марганец – серебристо-белый, твёрдый и хрупкий металл. С большинством неметаллов марганец образует соединения в степени окисления +2. Например, в реакции марганца с хлором образуется хлорид марганца (II), в реакции с серой – сульфид марганца (II). При взаимодействии марганца с кислотами-неокислителями также образуются двухвалентные соединения. Так, в реакции с соляной кислотой образуются хлорид марганца (II) и водород:
Mn + Cl2 = MnCl2
Mn + S = MnS
Mn + 2HCl = MnCl2 + H2↑.
Гидроксид марганца (II) проявляет основные свойства, его можно получить в реакциях растворимых солей марганца с растворами щелочей или аммиака. Например, в реакции сульфата марганца (II) с гидроксидом натрия образуются гидроксид марганца (II) и сульфат натрия. Гидроксид марганца (II) представляет собой бледно-розовый гидроксид, который легко окисляется и изменяет свою окраску на бурую:
MnSO4 + 2NaOH = Mn(OH)2↓ + Na2SO4.
Окислить марганец до высокой степени окисления возможно в щелочной среде, при этом получаются соединения марганца (VI). Например, в реакции гидроксида марганца (II) с бромом и гидроксидом натрия образуются манганат натрия, бромид натрия и вода:
Mn(OH)2 + 2Br2 + 6NaOH = Na2MnO4 + 4NaBr + 4H2O.
К важным соединениям марганца относится KMnO4 – перманганат калия. Он проявляет сильные окислительные свойства. В реакции перманганата калия с концентрированной серной кислотой образуются оксид марганца (VII), гидросульфат калия и вода:
2KMnO4 (тв.) + 2H2SO4 (конц.) = Mn2O7 + 2KHSO4 + H2O.
Оксид марганца (VII) – тёмно-зелёная маслянистая жидкость, она вязкая. Это сильный окислитель, но термически неустойчив. При разложении образуются оксид марганца (IV) и кислород:
2Mn2O7 = 4MnO2 + 3O2↑.
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло - и электропроводностью. На воздухе медь покрывается плотной зелёно-серой пленкой, которая защищает её от дальнейшего окисления.Медь не растворяется в кислотах-неокислителях, но реагирует с кислотами-окислителями. Так, в реакции меди с концентрированной азотной кислотой образуются нитрат меди (II), оксид азота (IV) и вода; в реакции меди с разбавленной азотной кислотой образуются нитрат меди (II), оксид азота (II) и вода; в реакции меди с концентрированной серной кислотой образуются сульфат меди (II), оксид серы (IV) и вода:
Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3 (разб.) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Cu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O.
При добавлении щелочей к растворам солей меди (II) образуется голубой осадок. Так, в реакции нитрата меди (II) с гидроксидом натрия образуются гидроксид меди (II) и нитрат натрия:
Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3.
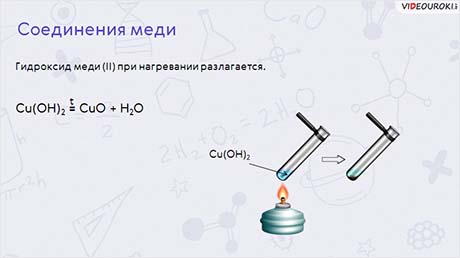
Гидроксид меди (II) при нагревании разлагается на оксид меди (II) чёрного цвета и воду:
Cu(OH)2 = CuO + H2O.
Оксид меди (II) можно восстановить до металлической меди различными восстановителями: углём, угарным газом, водородом, аммиаком, аминами и металлами. Например, в реакции оксида меди (II) с водородом образуются медь и вода, в реакции оксида меди (II) с аммиаком образуются медь, вода и азот, в реакции оксида меди (II) с этиламином образуются медь, оксид углерода (IV), вода и азот:
CuO + H2 = Cu + H2O
3CuO + 2NH3 = Cu + 3H2O + N2↑
15CuO + 2C2H5NH2 = 15Cu + 4CO2↑ + 7H2O + N2↑.
Восстановить медь можно в растворе, если в качестве восстановителей использовать более активные металлы, которые стоят в ряду активности левее меди. Например, в реакции сульфата меди (II) c цинком образуются сульфат цинка и медь:
CuSO4 + Zn = ZnSO4 + Cu.
Соединения меди (II) проявляют окислительные свойства. Например, в реакции хлорида меди (II) с йодидом натрия образуются йодид меди (II), йод и хлорид натрия:
2CuCl2 + 4NaI = 2CuI↓ + I2 + 4NaCl.
Оксид меди (I) – Cu2O реагирует с кислотами. Например, в реакции с соляной кислотой этот оксид образует соль – хлорид меди (I) и воду, а в реакции с азотной кислотой – нитрат меди (II), оксид азота (II) и воду:
Cu2O + 2HCl = 2CuCl↓ + H2O
3Cu2O + 14HNO3 (разб.) = 6Cu(NO3)2 + 2NO↑ + 7H2O.
Рассмотрим важнейшие соединения 3d-металлов и их применение. Медный купорос CuSO4 ∙ 5H2O используется для борьбы с вредителями сельского хозяйства. Перманганат калия – марганцовка – KMnO4 используется в медицине, оксид марганца (IV) – MnO2 применяются в химических источниках тока. Железная окалина – Fe3O4 – используется в производстве лент и запоминающих устройств; бихромат калия – K2Cr2O7 – используют как окислитель в химических лабораториях, а также как дубитель кож; бромид серебра (I) – AgBr – используют как светочувствительное вещество в производстве фотоматериалов; оксид титана (IV) – TiO2 – это белый пигмент в производстве красок (титановые белила); оксид хрома (III) – Cr2O3 – это абразивное вещество в шлифовальных пастах, а также зелёный красящий пигмент. Хромокалиевые квасцы – K2SO4 ∙ Cr2(SO4)3 ∙ 24H2O – это дубильное вещество в кожевенной промышленности, а малахит (CuOH)2CO3 применяют для изготовления синих и зелёных красок, а также как поделочный камень, железный купорос – FeSO4 ∙ 7H2O – является консервантом древесины, а также ядохимикатом.

 Получите свидетельство
Получите свидетельство Вход
Вход




 209
209

