Вы уже знаете, что абсолютно все тела состоят из каких-либо веществ. Например, вот эта тележка полностью сделана из пластмассы, бутылка из-под молока — из стекла, а этот топор — из дерева и стали. В свою очередь, все вещества обладают различными и только им присущими свойствами: цветом, запахом, плотностью, текучестью и так далее.
Но давайте вспомним, что общего у всех веществ? Для этого проведём простой опыт. В стакан с горячим чаем положим кусочек сахара. Через некоторое время крупинки сахара исчезнут, а чай стает сладким. Значит, сахар не исчез. Он остался в чае. А почему крупинки не видны? Правильно, они распались на мельчайшие частицы, не видимые глазом.

Так вот, мельчайшие частицы вещества, способные существовать самостоятельно и сохраняющие химические свойства вещества, называются молекулами.
Не только сахар, но и все другие вещества состоят из мельчайших частиц, то есть имеют дискретное (прерывистое) строение. А свойства различных веществ обусловлены тем, что разные вещества состоят из разных молекул.
Интересно, что гипотеза о дискретном строении вещества впервые была сформулирована ещё древнеиндийскими и древнегреческими философами, среди которых особо выделяется Демокрит Абдерский. Легенда рассказывает, что однажды он сидел на камне у моря, держал в руке яблоко и размышлял: «Если я сейчас это яблоко разрежу пополам, то у меня останется половина яблока. Если я затем эту половину снова разрежу на две части — останется четверть яблока. Но что если я и дальше буду продолжать такое деление? Не приведёт ли это к тому, что оставшаяся часть уже не будет обладать свойствами яблока?»

Таким образом, Демокрит пришёл к выводу о том, что предел делению существует. А эту последнюю, уже неразрезаемую, неделимую частицу он назвал атомом.
Лишь в XVII—XIX веках учёным удалось экспериментально подтвердить эту идею, показав, что некоторые вещества не могут быть подвергнуты дальнейшему расщеплению на составляющие элементы с помощью химических методов.
Но самое главное доказательство существования мельчайших частиц и, в частности, атомов, было получено после изобретения в 1981 году сканирующего туннельного микроскопа. С его помощью были получены первые фотографии атомов некоторых веществ.

Принцип работы такого микроскопа достаточно простой. Очень острая игла (на её кончике буквально один атом) подводится к образцу на расстояние порядка 0,1 нм. При подаче на иглу относительно образца очень малого напряжения возникает так называемый туннельный ток, величина которого зависит от расстояния образец — игла. Игла, как правило, движется на фиксированной высоте над образцом. А приборы фиксируют изменения величины туннельного тока и строят топографию поверхности.

Справедливости ради хочется отметить, что в конце XIX — начале XX века физиками были открыты субатомные частицы и составная структура атома. Тогда стало ясно, что реальная частица, которой было присвоено имя атома, в действительности не является неделимой.
В настоящее время под атомом понимают наименьшую часть химического элемента, являющуюся носителем его свойств.
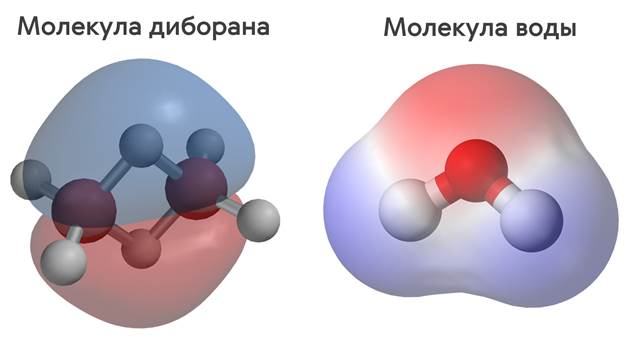
Таким образом, большинство веществ на Земле состоят из молекул, которые, в свою очередь, состоят из атомов. На рисунке вы видите модель молекулы диборана — сильно ядовитого газа. Она состоит из двух атомов бора и шести атомов водорода. А, например, молекула воды состоит из одного атома кислорода и двух атомов водорода.
Однако в природе существуют и вещества, которые состоят лишь из атомов. Например, алмаз и графит состоят только из атомов углерода.
Заметим, что на рисунках показаны не сами атомы и молекулы, а их модели — шарики. В действительности никаких соединительных стержней или проволочек между частицами нет.
Всего же на начало 2022 года учёными обнаружены 118 атомов химических элементов: от водорода до оганесона. Но только 91 из них встречается в природных условиях. Остальные были получены в лабораторных условиях.
Как из 33 букв алфавита образуется множество разных слов, так и из атомов образуется множество различных молекул — от самых простых до очень сложных. Так, например, молекула кислорода имеет всего два атома. А вот молекула гемоглобина (вещества крови, которое переносит кислород) состоит из 1400 атомов.

Конечно же общее же число атомов и молекул во Вселенной не знает никто. И вряд ли когда-нибудь узнает. Вы только представьте. Если взять все молекулы газа, находящиеся в 1 см3 воздуха и нанизать их на воображаемую нить так, чтобы они касались друг друга, то получившейся нитью можно было бы 200 раз обмотать по экватору нашу планету. А если эти молекулы начать пропускать через маленькое отверстие по миллиону штук в секунду, то последние молекулы пролетят через отверстие примерно через 840 000 лет. Так велико число молекул лишь в 1 см3 воздуха и так малы их размеры.
Итак, молекулы вещества можно разделить на атомы. Эти атомы, соединяясь с другими атомами, способны образовывать новые вещества с новыми свойствами. Например, вода под действием электрического тока может превратиться в газы: водород и кислород. И их свойства будут сильно отличаться от свойств воды.
Или, например, вы знаете, что при нагревании вода переходит в газ (пар), а при охлаждении — в лёд. И пар, и вода, и лёд состоят из одинаковых молекул. Однако эти молекулы по-разному взаимодействуют друг с другом. Поэтому свойства льда, воды и пара разные.

А теперь подумаем, если все тела состоят из мельчайших частиц, то почему же твёрдые тела и жидкости не распадаются на отдельные молекулы или атомы? Что заставляет их держаться вместе? Правильно — это силы межмолекулярного взаимодействия. Даже сам факт существования твёрдых и жидких тел говорит нам о том, что между частицами веществ существуют силы взаимного притяжения. Оно и понятно, не было бы притяжения — не было бы и тел. Каждая молекула притягивает к себе все соседние молекулы и сама притягивается ими.
Чтобы доказать это, проведём такой опыт. Подвесим на пружине чистую стеклянную пластинку и отметим положение нижнего конца пружины указателем. Поднесём к пластинке сосуд с водой до соприкосновения её с поверхностью воды. А теперь начнём медленно опускать сосуд до отрыва пластинки. Как видим, растяжение пружины увеличится, что указывает на притяжение частиц воды в сосуде и на поверхности стеклянной пластины.

Можно даже сцепить два свинцовых цилиндра вместе, если их вплотную прижать друг к другу ровными, только что срезанными поверхностями. При этом сцепление может быть настолько прочным, что цилиндры не удаётся оторвать друг от друга даже при большой нагрузке
С другой стороны, относительно малая сжимаемость жидкостей и твёрдых тел указывает нам на то, что между молекулами вещества существуют и силы отталкивания. В противном случае мы могли бы сжать любое тело до размеров молекулы или атома.
Ну а то, что большинство тел обладают определёнными размерами и формой говорит о том, что силы притяжения и отталкивания действуют одновременно.
Очень важно понять, что притяжение и отталкивание частиц вещества проявляются лишь на малых расстояниях между частицами, то есть в твёрдых телах и жидкостях. В газах же взаимодействия между молекулами настолько малы, что ими часто пренебрегают.
Взаимодействие двух молекул условно можно сравнить со взаимодействием двух шариков, скреплённых пружиной. Когда пружина растянута шарики притягиваются друг к другу. А если пружину сжать, то шарики начинают отталкиваться. Хотя эта модель и весьма наглядна, тем не менее она имеет один недостаток: на больших расстояниях притяжение, создаваемое пружиной, становится все сильнее. У молекул же, как мы отмечали ранее, оно практически исчезает.

Притяжение и отталкивание частиц определяют их взаимное расположение в веществе. А от расположения частиц существенно зависят свойства вещества. Так, глядя на прозрачный очень твёрдый алмаз и на мягкий чёрный графит мы и не догадываемся, что оба вещества состоят из совершенно одинаковых атомов углерода. Просто в графите эти атомы расположены иначе, чем в алмазе.
Взаимодействие частиц вещества приводит к тому, что оно может находиться в различных агрегатных состояниях. Традиционно выделяют три агрегатных состояния: твёрдое, жидкое и газообразное. К агрегатным состояниям принято причислять также плазму, в которую переходят газы при повышении температуры и фиксированном давлении. Существуют и другие агрегатные состояния веществ, наблюдаемые при очень низких температурах.
В различных агрегатных состояниях вещества расстояние между его молекулами различно. Отсюда и различие в силовом взаимодействии молекул и существенное различие в характере движения молекул.

Например, вы знаете, что расстояние между молекулами в газах достаточно велико (во много раз больше самих молекул). Поэтому силы взаимодействия между молекулами очень малы. Но вот скорости их движения достаточно велики (порядка нескольких сотен метров в секунду). Поэтому даже при редких (в масштабах молекул) столкновениях сил притяжения не хватает, чтобы удержать молекулы друг возле друга. Сталкиваясь, они разлетаются в разные стороны, подобно бильярдным шарам. Поэтому газы не сохраняют ни своей формы, ни объёма и могут неограниченно расширяться.
Каждый из вас посчитает сущей нелепицей утверждения вроде «Воздух занимает половину объёма этой комнаты». Или «Я накачал воздух в две трети объёма мяча». Воздух, как и любой газ, занимает весь объём комнаты и весь объём мяча.
В жидкостях дела обстоят несколько иначе. Вы знаете, что молекулы жидкостей очень плотно упакованы и колеблются около своего положения равновесия, сталкиваются с соседними молекулами и иногда меняются с ними местами (они своего рода «кочевники»). Плотная упаковка молекул жидкости приводит к тому, что при попытках уменьшить объём жидкости силы межмолекулярного отталкивания резко возрастают. Это приводит к тому, что жидкости легко сохраняют свой объём, но при этом они не могут сохранить свою форму (то есть они текучи).
Текучесть жидкостей на пальцах можно объяснить так. Возьмём сосуд с водой и наклоним его так, чтобы жидкость смогла выливаться. На жидкость действует внешняя сила — сила тяжести. И хотя она не может заметно изменить число «перескоков» молекул с одного равновесного положения в другое, она указывает молекулам в каком направлении следует эти перескоки совершить — по линии действия внешней силы. Вот почему жидкость обладает текучестью и легко меняет свою форму, но не объём.
Что касается твёрдых тел, то в них силы взаимодействия между молекулами так велики, что они не дают возможности частицам разойтись. Поэтому молекулы могут совершать лишь колебания с очень маленькой амплитудой около своих положений равновесия — узлах кристаллической решётки. Это приводит к тому, что твёрдые тела, в отличии от жидкостей и, тем более газов, сохраняют и свою форму, и свой объём. И действительно, сплошной деревянный мячик будет сохранять форму шара и объём, куда бы его ни поместили: в банку, на стол или приклеили бы к потолку.

 Получите свидетельство
Получите свидетельство Вход
Вход





 2306
2306

