Еще
в 1774 г. английский химик Дж. Пристли, используя стеклянную
двояковыпуклую линзу (большое увеличительное стекло), направил
сконцентрированный ею пучок солнечных лучей на оксид ртути (II)
и получил кислород. Запишем уравнение этой реакции: 2HgO
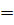 2Hg
+ O2↑.
Обратите внимание, что в реакцию вступило одно вещество, а образовалось два
вещества. Эта реакция требует нагревания, поэтому температуру ставят
в уравнении над знаком равенства. Стрелка, направленная вверх у кислорода,
показывает, что это газ.
2Hg
+ O2↑.
Обратите внимание, что в реакцию вступило одно вещество, а образовалось два
вещества. Эта реакция требует нагревания, поэтому температуру ставят
в уравнении над знаком равенства. Стрелка, направленная вверх у кислорода,
показывает, что это газ.
В настоящее время реакции разложения широко распространены. Например, разложение воды происходят в специальном устройстве – электролизёре. При электролизе воды получают чистый кислород.
2Н2О
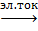 2Н2↑
+ О2↑
2Н2↑
+ О2↑
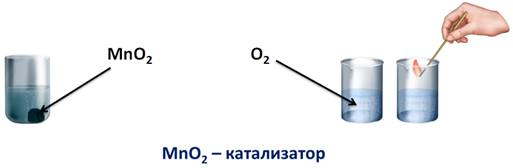
Однако, для получения кислорода в лаборатории, используют пероксид водорода (Н2О2). Если подогреть небольшое количество пероксида водорода, не доводя его до кипения, кислород выделяется очень медленно. Об этом можно судить, если поднести к пробирке, где собирался кислород, тлеющую лучинку.
2Н2О2 = 2Н2О + О2↑.
Для того чтобы она вспыхнула, кислорода в данном случае недостаточно, т.е. реакция идет с небольшой скоростью. Но если, в пероксид водорода добавить порошка оксида марганца (IV), то реакция пойдет очень быстро, кислород интенсивно выделяется в виде газа, и если поднести тлеющую лучинку, то она вспыхнет из-за большого количества кислорода. В данном случае, можно говорить о большой скорости реакции. Т.е. скорость реакции – это быстрота ее протекания или быстрота превращения одних веществ в другие. Вторая реакция пошла гораздо быстрее первой. В первом случае мы нагревали пероксид водорода, а во втором – использовали вещество – оксид марганца (IV), именно оно ускорило химическую реакцию. Его называют катализатором.
Катализатор – это вещество, ускоряющее химическую реакцию, но само при этом остается неизмененным.
Доказать, что оксид марганца (IV) не расходуется в реакции очень просто. В результате разложения пероксида водорода образуется вода, если к ней долить еще некоторую порцию пероксида водорода, то реакция опять протекает так же бурно, т.е. оксид марганца (IV) остался в результате реакции неизменным.
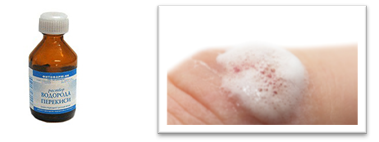
В жизни мы тоже используем перекись водорода, обрабатывая раны. При этом происходит тоже бурное выделение кислорода. А сам процесс идет с помощью биологического катализатора – фермента каталазы. Т.е. ферменты – биологические катализаторы белковой природы. Большинство процессов в живых организмах протекает благодаря ферментам. Ферменты используются в стиральных порошках для удаления крови, белков, чая; с помощью ферментов варят пиво, изготавливают сыры, лекарственные средства.
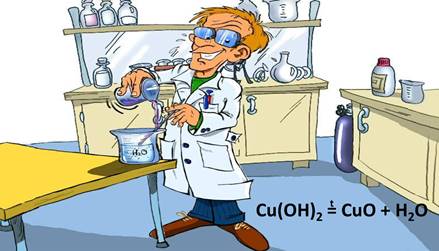
Рассмотрим еще несколько примеров реакций разложения. Если в пробирке на пламени спиртовки подогреть студенистый осадок гидроксида меди (II), то он начинает чернеть из-за образовавшегося оксида меди (II).
Cu(OH)2 = CuO + H2O
Это тоже реакция разложения: из одного сложного вещества – гидроксида меди (II) образовалось два новых – оксид меди (II) и вода.
В промышленности для получения негашеной извести – СаО – и углекислого газа используют реакцию разложения известняка, основу которого составляет карбонат кальция.
СаСО3 = СаО + СО2↑
В лаборатории для получения кислорода используют реакцию разложения перманганата калия – KMnO4 – «марганцовки».
2KMnO4 = K2MnO4 + MnO2 + O2↑
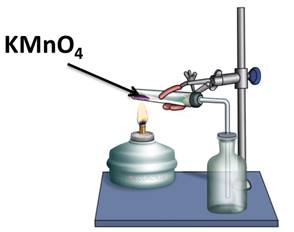
В данной реакции из одного сложного вещества образовалось два сложных и одно простое. Из этого можно сделать вывод, что реакции разложения – это реакции, в результате которых из одного сложного вещества образуется два и более новых веществ.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 11647
11647

