До определённого момента считалось, что атом — неделимая частица. Однако, это не так: в атоме есть ядро, вокруг которого вращаются электроны. Это было открыто в начале двадцатого века в совместных работах Нильса Бора и Эрнеста Резерфорда, которые внесли большой вклад в изучение физико-химических процессов на микроскопическом уровне.

На прошлом уроке мы уже узнали, что электрон имеет отрицательный заряд, но, несмотря на это, все молекулы не имеют заряда. Дело в том, что суммарный отрицательный заряд всех электронов уравновешивается положительным зарядом ядра. Заряд ядра является одной из главных характеристик того или иного химического элемента. Частицы ядра атома, имеющие положительный заряд, называются протонами. Заряд каждого протона численно равен заряду электрона, но имеет противоположный знак:
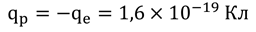
Однако, масса протона значительно больше:
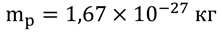
Помимо протонов, в ядре атома существуют другие частицы, которые не имеют электрического заряда, но по размеру и массе мало отличаются от протонов. Такие частицы назвали нейтронами.
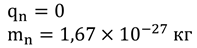
Итак, в центре атома находится ядро, которое состоит из протонов и нейтронов, а вокруг ядра вращаются электроны.
Однако, существует одно исключение: у водорода нет нейтронов в ядре, поскольку всё ядро водорода состоит из одного протона, вокруг которого вращается один электрон. У гелия, например, ядро состоит из двух протонов и двух нейтронов, а вокруг вращается два электрона. Вообще из периодической системы химических элементов Менделеева можно узнать число протонов в ядре любого элемента, поскольку порядковый номер элемента совпадает с этим числом. При нормальных условиях, атом содержит то же число электронов. Например, у азота 7 протонов, а у хлора — 17.
Мы можем предположить, что возможно каким-то образом отнять электрон у нейтрального атома или присоединить электрон к нейтральному атому. Действительно, это предположение верно, и такие процессы часто происходят. Электроны одних атомов могут переходить к другим атомам. Атомы с неравным количеством протонов и электронов называются ионами.
Если атом потерял один или несколько электронов, то он будет иметь положительный заряд и называться положительным ионом.
Если же атом, напротив, приобрел один или несколько лишних электронов, то он будет иметь отрицательный заряд и называться отрицательным ионом.
Для закрепления материала выполним несколько простых упражнений.
Задача 1. Известно, что атом кислорода электрически нейтрален, а в его ядре находится 16 частиц. Сколько в атоме кислорода протонов, нейтронов и электронов?
В таблице Менделеева кислород имеет порядковый номер 8. Значит, в нём 8 протонов. Поскольку атом электрически нейтрален, в нём должно быть 8 электронов, чтобы уравновесить заряд ядра. Нам дано, что в ядре 16 частиц. Т.к. 8 из них являются протонами, оставшиеся 8 — это нейтроны. Значит, в атоме кислорода 8 нейтронов и 8 протонов, которые формируют ядро, а вокруг этого ядра вращаются 8 электронов.
Задача 2. Как называется атом кальция, который потерял 2 электрона? Каков заряд этого атома?
Для ответа на этот вопрос нам не нужна таблица Менделеева. Т.к. атом изначально нейтрален, то при потере электронов, он становится положительным ионом. Сколько бы ни было протонов в ядре, заряд каждого из них уравновешивается отрицательным зарядом электрона, за исключением двух, поскольку в атоме не хватает двух электронов. Поэтому заряд данного иона будет равен суммарному заряду двух протонов.
Задача 3. Атом содержит 6 нейтронов и электрически нейтрален. Можно ли найти число протонов и электронов?
Нет, потому что число протонов не всегда совпадает с числом нейтронов. Можно лишь сказать, что число протонов в этом атоме равно числу электронов, поскольку в противном случае, это был бы ион. Шесть нейтронов содержится в нормальном атоме углерода, но, 6 нейтронов могут находиться в некоторой разновидности атома гелия. Такие разновидности называются изотопами и часто являются радиоактивными. Подобные явления будут изучены подробнее в старших классах.

 Получите свидетельство
Получите свидетельство Вход
Вход




 0
0 17724
17724

