Проведем опыт английского химика Г. Кавендиша. Для этого нальем в пробирку раствор соляной кислоты и поместим туда несколько гранул цинка. Мы видим выделение пузырьков газа. Соберем этот газ методом вытеснения воздуха, т.к. выделяющийся газ, водород, легче воздуха. Когда соберется достаточное количество газа, поднесем пробирку с газом водородом к пламени спиртовки, после чего раздастся взрыв, сопровождающийся «лающим» звуком. Этот взрыв произошел из-за смешения водорода с воздухом.

Смесь 2 объёмов водорода и 1 объема кислорода называют «гремучим газом». Если собрать чистый водород и поднести пробирку к горелке, то раздастся легкий хлопок, из-за сгорания чистого водорода. Откуда в реакции водород и какие ещё продукты образуются?
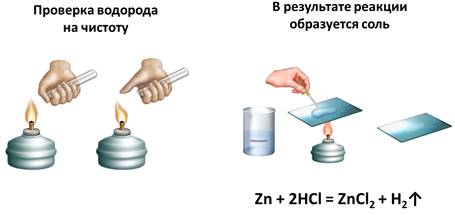
В результате этой реакции – между цинком и соляной кислотой – образуется соль (хлорид цинка). Это можно доказать, если немного этого раствора поместить на предметное стекло и выпарить. В результате вода испарится, а на стеле будут кристаллы соли. Теперь составим уравнение этой реакции: в реакцию вступает цинк и соляная кислота, в результате чего образуется соль – хлорид цинка и выделяется водород.
Zn + 2HCl = ZnCl2 + H2↑
Проведем дугой эксперимент. Нальем в четыре пробирки раствора соляной кислоты. В первую пробирку поместим кальций, во вторую – магний, в третью – цинк, в четвертую – медь. Понаблюдаем за процессом, будет ли выделение водорода во всех случаях, ведь в реакцию вступает металл и соляная кислота? Самое интенсивное выделение водорода наблюдается в первой пробирке, где был металл кальций, во второй пробирке – с металлом магнием – менее интенсивное, с цинком еще менее интенсивное, а с медью реакция не протекает, т.к. выделение водорода и вовсе не наблюдается.

Поэтому, для прогнозирования протекания реакции между металлом и кислотой, нужно использовать ряд активности металлов, или ряд напряжений металлов. Как видите, в этом ряду есть и водород, который металлом не является. Металлы, которые стоят в ряду напряжений металлов до водорода, способны вытеснять его из растворов кислот, те металлы, которые стоят в этом ряду после водорода, этой способностью не обладают.
Самые активные металлы находятся вначале ряда, менее активные – в конце. Т.к. кальций более активный, то выделение водорода в растворе кислоты шло интенсивнее, чем у магния или цинка. Медь не вытесняет водород из раствора кислот, потому как этот металл стоит в конце ряда. В этом вы сами убедились из предыдущего опыта.
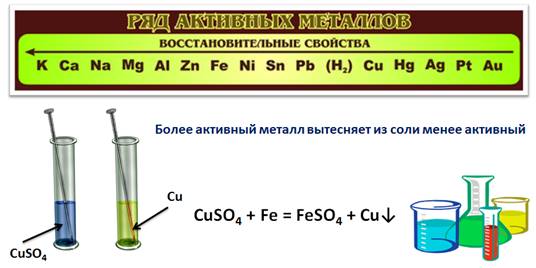
Ряд активности металлов используют также для прогнозирования реакций между металлом и раствором соли. Для этого нужно знать, что более активный металл вытесняет из раствора соли менее активный.
Проведем эксперимент: поместим в химический стакан с раствором сульфата меди (II) железный гвоздь. Через некоторое время на гвозде появляется красный налет, а раствор соли изменяет свою окраску. Красный налет – это выделившаяся медь, раствор изменил окраску, т.к. в результате реакции образовался раствор сульфата железа (II).
CuSO4 + Fe = FeSO4 + Cu↓
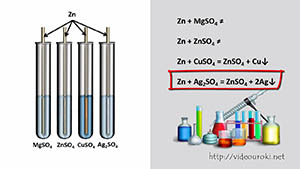
Если цинк поместить в растворы сульфатов магния, цинка, меди и серебра, то из всех этих растворов он вытеснит только медь в виде красного налёта и серебро в виде серебристо-белого налета. Магний более активный металл, чем цинк, т.к. в ряду активности стоит левее цинка, поэтому реакция не прошла, как и реакция цинка с раствором сульфата цинка.

Если поместить медь в раствор нитрата серебра, то через некоторое время на меди появляется серебристо-белый налет из-за образовавшегося серебра. Как видим, реакция протекает, т.к. медь стоит в ряду напряжений металлов левее серебра, т.е. является более активным металлом, чем серебро.

Все рассмотренные реакции являются реакциями замещения. Теперь можно сделать вывод, что реакции замещения – это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.


 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 8212
8212

