Амины можно рассматривать как производные аммиака, в молекулах которого один, два или три атома водорода замещены на радикалы.
Различают первичные, вторичные и третичные амины, в зависимости от того, сколько атомов водорода замещены в аммиаке. У первичных аминов есть группа -NH2, у вторичных аминов – NH, а у третичных – только атом азота.
По строению углеводородной цепи амины делятся на: алифатические, например, этиламин, алициклические, как циклогексиламин и ароматические, как 1, 4-диамино-бензол.
В составе первичных аминов есть группа – NH2, которую называют аминогруппой. Поэтому общая формула первичных аминов R-NH2, или CnH2n+1NH2, где CnH2n+1 – углеводородная группа.
Молекулы аминов имеют пирамидальное строение, а на атоме азота содержится неподелённая пара электронов. Связь в молекулах аминов сильно полярная за счёт того, что атом азота имеет высокую электроотрицательность, но связь менее поляризована в аминах, чем у спиртов.

Названия первичных аминов по международной номенклатуре состоят из названий соответствующих углеводородов с добавлением слова «амин». Назовём первичные амины. Первый амин называется метанамин, или метиламин, второй – этанамин, или этиламин, третий амин называется пропанамин-1, или пропиламин, четвёртый амин называется пропанамин-2, или изопропиламин.

Вторичные амины по международной номенклатуре называют так: сначала указывают наличие атома азота символом эн и после дефиса перечисляют младшую, потом старшую углеводородные группы, добавляя в конце слово «амин». Назовём вторичные амины. Первый амин называется N-метилэтиламин, второй амин называется N,N-диэтиламин.

Для аминов характерна изомерия углеродного скелета, или изомерия цепи, а также изомерия положения аминогруппы.
Составим всевозможные изомеры к амину состава C5H11NH2. Стуктурными изомерами будут: пентанамин-1, 2-метилбутанамин-1, и 2,2-диметилпропанамин-1.
Изомерами по положению аминогруппы будут: пентанамин-1, пентанамин-2, пентан-амин-3.
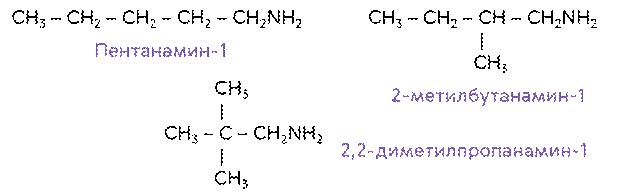
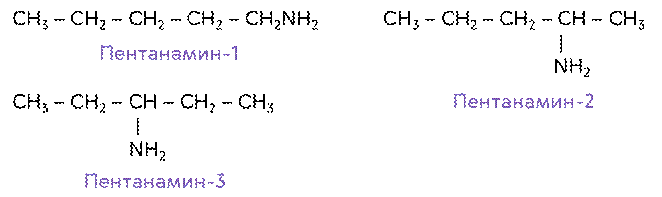
Для аминов характерна также изомерия алкильных групп. Так, первичные, вторичные и третичные амины, у которых одинаковое число атомов углерода, будут по отношению друг к другу изомерами. Например, изомерами между собой являются пропиламин и N-метил, N-этиламин.
Рассмотрим физические свойства аминов.
Первые представите аминов – газы, имеют запах аммиака, хорошо растворяются в воде. Средние представители ряда аминов являются жидкостями со слабым запахом тухлой рыбы. Высшие амины – твёрдые нерастворимые вещества, которые не имеют запаха.
Амины имеют более высокую температуру кипения, чем алканы с тем же числом атомов углерода. Амины кипят при более низкой температуре, чем соответствующие спирты. Среди изомерных аминов третичные имеют наименьшую температуру кипения.
За счёт неподелённой пары электронов на атоме азота, амины, как и аммиак, проявляют основные свойства. Таким образом, амины – это органические основания, причём более сильные, чем аммиак, за счёт влияния алкильных групп. Так, диметиламин – более сильное основание, чем метиламин. Так как амины проявляют основные свойства, среда в их растворах будет щелочная.
Так, при растворении метиламина в воде образуется щелочной раствор и ион метиламмония:
CH3NH2 + HOH ↔ CH3NH3+ + OH-.
Амины реагируют с кислотами с образованием соответствующих солей. Так, в реакции этиламина с соляной кислотой образуется соль – хлорид этиламмония, в реакции метиламина с уксусной кислотой образуется соль – ацетат метиламмония:
C2H5 – NH2 + HCl → [C2H5NH3]+Сl-
CH3 – NH2 + CH3COOH → [CH3 NH3]+ООСCH3- .
Однако если реакция этого же амина с уксусной кислотой будет протекать при нагревании, то образуется не соль, а амид:
CH3 – NH2 + CH3COOH → CH3CONHСCH3.
Если на соли аминов подействовать щёлочью, то образуется исходный амин. Так, при действии на соль – хлорид этиламмония гидроксидом калия образуется этиламин:
[C2H5NH3]+Сl- + NaOH → C2H5NH2 + NaCl + H2O.
Для аминов характерны реакции горения. Так, при горении метиламина образуются оксид углерода (IV), вода и азот:
4CH3NH2 + 9O2 → 4CO2↑ + 10H2O + 2N2↑.
Анилин, или фениламин – С6H5NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом, плохо
растворим в воде, но хорошо растворяется в органических растворителях.
Температура кипения 184 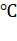 , а температура плавления - 6
, а температура плавления - 6 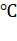 . На воздухе быстро
окисляется и приобретает красно-бурую окраску. Ядовит.
. На воздухе быстро
окисляется и приобретает красно-бурую окраску. Ядовит.
В молекуле анилина проявляется взаимное влияние атомов. Так, под действием амино-группы повышается электронная плотность в положениях 2, 4, 6 бензольного кольца; кроме того реакции замещения в кольце протекают легче, чем для бензола.
Под влиянием бензольного кольца ослабляются основные свойства анилина по сравнению с основными свойствами аммиака и алифатичеких аминов.
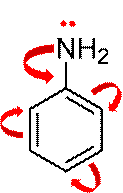
Рассмотрим химические свойства анилина. Анилин практически не реагирует с водой. Но он реагирует с кислотами. Так, в реакции анилина с бромоводородной кислотой образуется бромид фениламмония:
C6H5 – NH2 + HBr → [C6H5NH3]+Br-.
Анилин легко реагирует с бромной водой. При этом образуется белый осадок 2,4,6-триброманилина. Данная реакция является качественной для определения анилина:
C6H5NH2 + 3Br2 → C6H2NH2Br3↓ + 3HBr.
В лаборатории первичные амины получают восстановлением нитросоединений. Так, при восстановлении нитрометана водородом в присутствии никелевого катализатора образуется метиламин и вода.

Анилин в лаборатории получают восстановлением нитробензола железом в присутствии соляной кислоты.
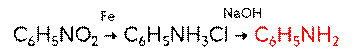
В промышленности амины также получают в реакции спирта и аммиака под давлением. Так, в реакции метанола с аммиаком в присутствии катализатора – оксида алюминия, образуется метиламин.

В промышленности анилин получают по реакции Зинина, то есть восстановлением нитробензола. Эта реакции идёт под давлением в присутствии катализаторов.

Осуществим следующие превращения: из этанола получим этиламин, из этиламина получим бромид этиламмония, а из него – этиламин, из этиламина получим азот.

Решим задачу. Через безводную смесь анилина, фенола, бензола общей массой 120 г пропустили хлороводород. При этом образовался осадок, масса которого 62,16 г. Осадок отфильтровали, а фильтрат обработали водным раствором гидроксида натрия. При этом образовалось два слоя: объём верхнего слоя равен 42,5 мл, а плотность его 0,58 г/мл. Определите массовые доли анилина и бензола в исходной смеси.


 Получите свидетельство
Получите свидетельство Вход
Вход





 303
303

