По агрегатному состоянию оксиды делятся на твёрдые, как оксид калия, оксид алюминия, оксид фосфора пять и другие; на жидкие, как оксид серы шесть, оксид марганца семь и газообразные, как оксид углерода четыре, оксид азота четыре, оксид серы четыре и другие.
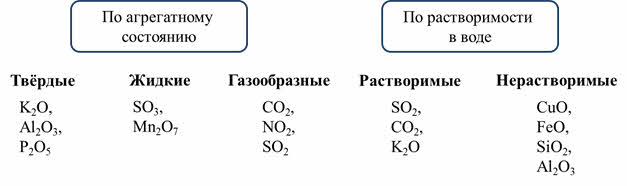
По растворимости в воде оксиды делятся на растворимые, как оксид серы четыре, оксид углерода четыре, оксид калия и другие; и нерастворимые, как оксид меди два, оксид железа два, оксид кремния четыре, оксид алюминия и другие.

Все кислотные оксиды, кроме оксида кремния четыре, растворимы в воде. Среди основных оксидов растворимыми являются только оксиды щелочных металлов (оксид лития, оксид натрия, оксид калия и так далее) и щелочноземельных металлов (оксид кальция, оксид стронция, оксид бария). Амфотэрные оксиды не растворяются в воде.
Оксиды имеют различный цвет: так, оксид меди два – чёрный, оксид никеля два – зелёный, оксид кальция – белый.
Рассмотрим химические свойства основных оксидов.
Основные оксиды реагируют с кислотами с образованием соли и воды.
Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.

В реакции оксида железа три с серной кислотой образуется соль – сульфат железа три и вода.
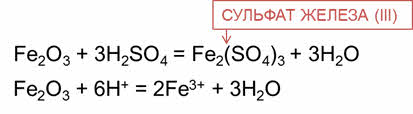
В реакции оксида кальция с серной кислотой образуется соль – сульфат кальция и вода.
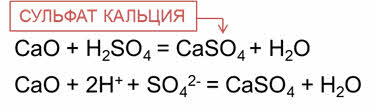
Кристаллы этой соль известны под названием «гипс».

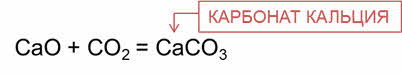
Основные оксиды взаимодействуют с кислотными оксидами с образованием солей.

Так, в реакции оксида кальция с оксидом углерода четыре образуется соль – карбонат кальция. Эту соль известная под названием «мел».
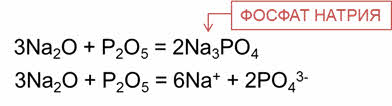
В реакции оксида натрия с оксидом фосфора пять образуется соль – фосфат натрия.
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с образованием растворимых оснований – щелочей.
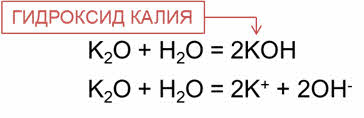
Так, в реакции оксида калия с водой образуется щёлочь – гидроксид калия; в реакции оксида кальция с водой образуется гидроксид кальция.

Эта реакция – гашение извести, которая сопровождается выделением большого количества тепла.
Оксиды других металлов в воде не растворяются и с ней не взаимодействуют. Как например, оксид меди два, или оксид железа три и другие.
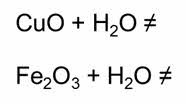
Общим свойством всех кислотных оксидов является их способность взаимодействовать с основаниями с образованием соли и воды.

Так, в реакции оксида углерода четыре с гидроксидом натрия образуется соль – карбонат натрия и вода.
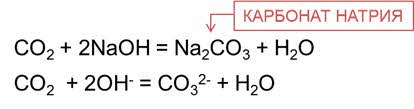
В реакции оксида фосфора пять с гидроксидом бария образуется соль – фосфат бария и вода.
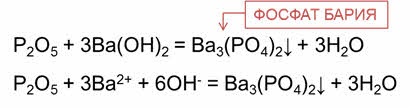
Кислотные оксиды взаимодействуют с основными оксидами с образованием солей. Так, в реакции оксида серы шесть с оксидом калия образуется соль – сульфат калия.
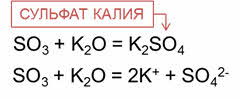
Большинство кислотных оксидов взаимодействуют с водой с образованием кислот.

Например, в реакции оксида серы шесть с водой образуется серная кислота.
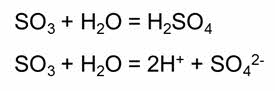
Амфотэрные оксиды взаимодействуют с кислотами с образованием соли и воды.

Так, в реакции оксида цинка с азотной кислотой образуется соль – нитрат цинка и вода.
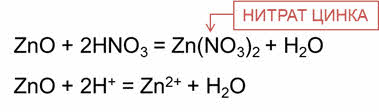
В этих реакциях амфотэрные оксиды играют роль основных оксидов.
Амфотэрные оксиды взаимодействуют со щелочами с образованием солей и воды.

Так, в реакции оксида цинка с гидроксидом калия образуется соль – цинкат калия и вода.
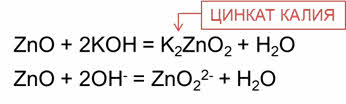
В этих реакциях амфотэрные оксиды играют роль кислотных оксидов.
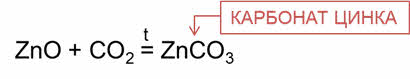
Амфотэрные оксиды при нагревании взаимодействуют с кислотными оксидами с образованием солей.

Так, в реакции оксида цинка с оксидом углерода четыре образуется соль – карбонат цинка.
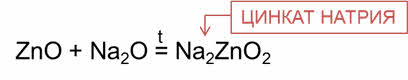
Амфотэрные оксиды при нагревании взаимодействуют с основными оксидами с образованием солей.

Например, в реакции оксида цинка с оксидом натрия образуется соль – цинкат натрия.
Некоторые оксиды имеют специфические свойства. У хлора известны такие оксиды, как оксид хлора один, оксид хлора четыре, оксид хора семь и другие.

В реакции с водой оксид хлора один, образует хлорноватистую кислоту, оксид хлора четыре в реакции с водой образует хлорноватистую и хлорноватую кислоты; оксид хлора семь в реакции с водой образует хлорную кислоту.
Оксиды могут быть получены различными способами.
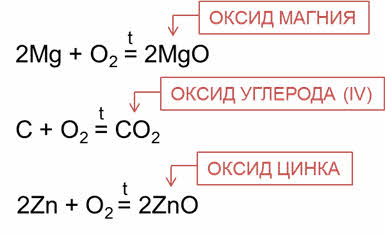
Это взаимодействие простых веществ с кислородом.
Например, в реакции магния с кислородом образуется оксид магния; в реакции углерода с кислородом образуется оксид углерода четыре, в реакции цинка с кислородом образуется оксид цинка.
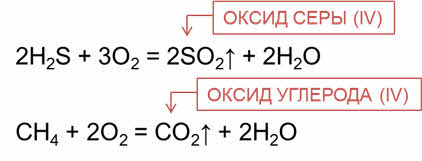
Оксиды можно получить и при горении сложных веществ. Так, в реакции горения сероводорода образуется оксид серы четыре и вода; в реакции горения метана образуется оксид углерода четыре и вода.
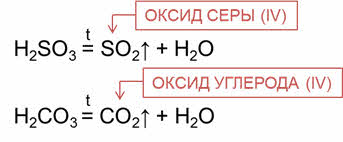
При разложение некоторых оксокислот также образуются оксиды.
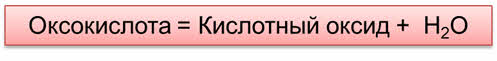
Так, в реакции разложения сернистой кислоты образуется оксид серы четыре и вода. В реакции разложения угольной кислоты образуется оксид углерода четыре и вода.
Оксиды можно получить и при разложении нерастворимых оснований.
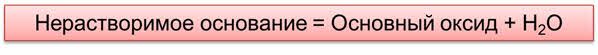
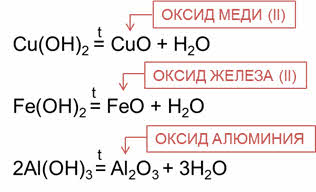
Например, при разложении гидроксида меди два образуется оксид меди два и вода. При разложении гидроксида железа два образуется оксид железа два и вода. При разложении гидроксида алюминия образуется оксид алюминия и вода.
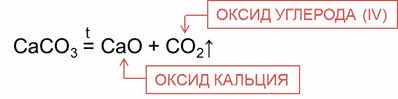
При разложении некоторых солей также образуются оксиды.

Так, при разложении карбоната кальция образуется оксид кальция и оксид углерода четыре.
При разложении нитрата меди два образуется оксид меди два (чёрного цвета), оксид азота четыре (бурого цвета) и кислород.
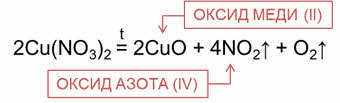
Ещё одним способом, которым можно осуществить получение оксидов – это окислительно-восстановительные реакции.
Например, в реакции меди с концентрированной азотной кислотой образуется нитрат меди два, оксид азота четыре и вода; в реакции серы с концентрированной азотной кислотой образуется оксид серы четыре и вода.

Таким образом, некоторые основные оксиды реагируют с водой, с образованием щелочей, основные оксиды реагируют с кислотными и амфотэрными оксидами, реагируют с кислотами; большинство кислотных оксидов реагируют с водой, кислотные оксиды реагируют с основными и амфотэрными оксидами, с основаниям; амфотэрные оксиды реагируют с основными и кислотными оксидами, реагируют с основаниями и кислотами.
Оксиды можно получить в реакции простых веществ с кислородом, горением сложных веществ, разложением солей, нерастворимых оснований, а также разложением некоторых кислот и в окислительно-восстановительных реакциях.

 Получите свидетельство
Получите свидетельство Вход
Вход





 2079
2079

