Продолжаем знакомство с органическими веществами клеток живых организмов.
Вы уже преодолели две ступеньки лестницы, познакомившись с углеводами и липидами. Дальше лестница подымается ещё круче вверх, становится страшнее, и может закружиться голова, но это только пока не взойдёшь и не освоишься на следующей ступеньке. Но как только это произойдёт, снова возникает жгучее желание взбираться дальше вверх к удивительному и неизведанному.
Сегодняшняя ступенька с белками достаточно сложная и насыщенная. Если, конечно, так можно сказать о ступеньке.
Белки имеют гораздо более запутанное строение, чем усвоенные вами углеводы и липиды. А соответственно обладают и гораздо более широким набором функций в организме.
Считается, что именно они являются основой жизни на Земле. Помните Фридриха Энгельса?
«Жизнь – это способ существования белковых тел, существенным
моментом которого является постоянный обмен веществ с
окружающей их природой, причём с прекращением этого обмена
веществ прекращается и жизнь, что приводит к разложению белков».
Конечно, белки не справились бы с возложенными на них функциями без своих командиров – молекул нуклеиновых кислот. Но следующая крутая ступенька с нуклеиновыми кислотами – носителями наследственной информации – ждёт вас впереди.
Вы помните, что и белки, и нуклеиновые кислоты являются полимерами. Помните, что полимеры состоят из мономеров. Так вот факт условного превосходства нуклеиновых кислот – если белковые молекулы насчитывают до нескольких десятков тысяч мономеров, то ДНК – до сотен миллионов.
Так что же представляют из себя эти загадочные белки при ближайшем рассмотрении?
Вначале о том, что вы уже могли знать.
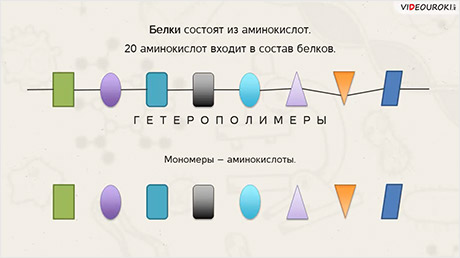
Как мы уже сказали, белки – полимеры. Мономерами белков являются аминокислоты. 20 различных аминокислот может входить в состав белков. Поэтому белки являются гетерополимерами. Поскольку могут содержать неодинаковые мономеры. 20 разных.
Здесь нужно отметить, что разнообразие живых организмов… практически бесконечно. Каждая особь живых существ, которая возникла в результате полового размножения (если это не однояйцевые близнецы), представлена своими уникальными белками. Сколько их может быть и каков порядок чисел? По разным данным на Земле существует до 10 миллионов видов живых организмов. Это уже минимум 10 миллионов комбинаций строения белковых молекул. Здесь следует учесть, что в каждом организме далеко не по одному белку. А что касается количества особей, то подсчитать становится просто невозможно. Например, только одних насекомых на одного человека приходится около 250 миллионов. Можете умножить 7 миллиардов на 250 миллионов.
Так вот, всё это разнообразие создаётся за счёт различного сочетания всего 20 (!) аминокислот. Невероятно, правда?
Давайте познакомимся поближе с теми кирпичиками, из которых состоят белки.
Если вы уже разобрались со строением карбоновых кислот, никаких сложностей не возникнет и с аминокислотами. Это вещества, содержащие не только карбоксильную группу COOH (отсюда кислота), но и аминогруппу NH2. Эти две функциональные группы обязательны для каждой аминокислоты.

А вот в остальном они очень разнообразны. Уникальная часть каждой аминокислоты – радикал. Может выглядеть по-разному и содержать не только атомы углерода, водорода, кислорода и азота, но и серу. В результате радикал может быть полярным и неполярным, гидрофобным или гидрофильным, что и придаёт разным аминокислотам особые свойства.
Если аминокислоты содержат одну карбоксильную группу и одну аминогруппу, которая придаёт им основные свойства, то они являются нейтральными амфотерными соединениями. Но количество функциональных групп может различаться у разных аминокислот. Те из них, которые имеют более одной аминогруппы, будут основными, а имеющие более одной карбоксильной группы – кислыми.
Важно отметить, что не все аминокислоты могут синтезироваться во всех живых организмах. Если автотрофы справляются с этим самостоятельно благодаря продуктам фотосинтеза, то гетеротрофам необходимо обязательное поступление некоторых аминокислот с белками пищи. Такие аминокислоты относят к незаменимым.
В зависимости от аминокислотного состава различают полноценные белки, содержащие все незаменимые аминокислоты, и неполноценные, в составе которых отсутствуют те или иные аминокислоты.
Именно поэтому людям, которые переходят к вегетарианству, нужно быть внимательными к своему рациону. Так как полноценными являются животные белки, от которых они отказались. И далеко не все растительные, на которые они перешли, являются полноценными.
Хотя та же соя заменяет мясо на 100%. Так как содержит все восемь незаменимых для человека аминокислот: треонин, фенилаланин, лизин, триптофан, валин, метионин, лейцин и изолейцин. В детском возрасте к ним добавляются аргинин и гистидин.
А вот вашему вниманию все белокобразующие аминокислоты и их общепринятые сокращения.

Запоминать это сейчас не нужно, но в дальнейшем с этими названиями и сокращениями вы будете работать. Не пугайтесь и привыкайте.
Каким образом происходит соединение аминокислот в белковые цепочки?
Благодаря наличию всё тех же функциональных групп, обуславливающих высокую реакционную способность аминокислот.
Аминогруппа одной аминокислоты способна взаимодействовать с карбоксильной группой другой аминокислоты. При этом образуется молекула воды и так называемая пептидная связь. Запомните, пептидная связь – это ковалентная связь между атомом азота аминогруппы одной аминокислоты и атомом углерода карбоксильной группы другой аминокислоты. Образующаяся молекула представляет собой дипептид.

Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом – свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты. Если таким образом собираются пептиды, содержащие до 10 остатков аминокислот, они называются олигопептидами. Если больше 10-ти – полипептидами. В организме человека пептидами являются многие гормоны, такие, как глюкагон, вазопрессин, окситоцин и другие. Также пептидами по химической природе являются антибиотик грамицидин, дифтерийный токсин и так далее.
Итак, мы сказали, что белки состоят из аминокислот, аминокислоты соединяются в цепочки, которые называются олигопептидами и полипептидами. А где же тогда белки? Белками называются полипептиды, содержащие от пятидесяти до нескольких тысяч аминокислот. То есть любой белок есть полипептид, но не каждый полипептид есть белок.
В состав белков могут входить не только аминокислоты. Если белок содержит компоненты неаминокислотной природы, то такой белок относят к сложным. Простые белки состоят только из аминокислот.
Структуры белковых молекул.
Углеводы и липиды, которые вы уже изучили, как и абсолютное большинство других веществ на этом своё строение заканчивают. Что имеется ввиду? Свойства этих веществ зависят только от цепочки соединённых между собой атомов. Других вариантов строения практически не существует, а значит и свойства, и роль в организмах живых существ всегда одна и та же.
С белками всё гораздо сложнее, а поэтому намного интереснее.
Просто цепочка (на первый взгляд просто, конечно же) аминокислот, соединённых друг с другом в полипептид, образует так называемую первичную структуру белковой молекулы.

Она является самой важной, так как именно она определяет конечные форму, структуру и, наконец, функции белка.
Если мы внимательно рассмотрим первичную структуру белка, то обнаружим там атомы с разной электроотрицательностью. Поэтому при попадании этого белка в воду между атомами кислорода остатков карбоксильной группы и атомами водорода остатков аминогруппы возникнут водородные связи. Из-за особенностей пространственного расположения атомов, это будет происходить через определённый промежуток – с первой аминокислоты на пятую, со второй – на шестую и так далее.
В результате наша “просто цепочка” свернётся в спираль. Или, точнее, в альфа-спираль.

Но возможен и вот такой вариант соединения белковых цепочек между собой водородными связями. Это так называемый складчатый слой или β-слой.
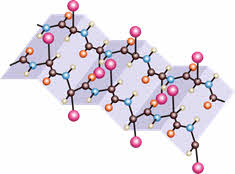
Спиральная структура характерна, например, для белка кератина, составляющего наши с вами волосы и ногти.
А вот натуральный шёлк состоит из белка фиброина, который имеет уже складчатую структуру.
Итак, мы с вами рассмотрели вторичную структуру белка. Она поддерживается водородными связями и может быть представлена либо альфа-спиралью, либо складчтым бета-слоем.
Третичная структура.
На цепочках, спиралях и слоях ещё всё не заканчивается, а можно сказать, только начинается.
Об этом не знали вплоть до 1959 года. Кстати, как и о вторичной структуре. Так вот, только в 1959 году (а это относительно совсем недавно) в результате исследований, растянувшихся на несколько лет, Джон Кендрью и Макс Перуц
методом рентгеноструктурного анализа определили структуры миоглобина (белка мышечной ткани) и гемоглобина (белка эритроцитов крови), а также предложили модели их молекул.
В 1962 году за свои работы они были удостоены Нобелевской премии.
Что
же представляет из себя третичная структура белка?
Изображение всё того же миоглобина говорит нам о том, что это нечто округлое и
шарообразное.

Подтверждение этому находим и в названии белка. Мио от греч. mys, родительный падеж myos – мышца и латинского globus – шар.
Сворачивание спиральной структуры белка происходит под воздействием водородных связей между разными группами атомов, гидрофобно-гидрофильных взаимодействий (когда гидрофобные части молекулы как бы прячутся от воды внутрь её), а также так называемых серных мостиков между атомами серы в остатках аминокислоты цистеина.
И четвертичная структура.
Этой
структурой обладают не все белки. Образование четвертичной структуры происходит
тогда, когда несколько полипептидов с третичной структурой соединяются в
комплекс.
Рассмотрим это на примере известного всем гемоглобина. Четыре полипептидные
глобулы здесь связываются в комплекс с небелковой частью – гемом.
Перед нами пример сложного белка, о которых мы говорили выше.

Сложность структуры белковых молекул обуславливает разнообразие функций, свойственных этим биополимерам. Но в тоже время и их неустойчивость. Под влиянием самых различных факторов белковые молекулы способны изменять свою структуру.
Процесс нарушения природной структуры белка без разрушения первичной структуры называется денатурацией. С утратой своей структуры белковая молекула теряет способность выполнять свои функции.
Зачастую денатурация необратима. Но в некоторых случаях при устранении повреждающего фактора белок может восстанавливать своё природное строение. Это пример ренатурации.

 Получите свидетельство
Получите свидетельство Вход
Вход



 0
0 6007
6007

