
Комплексные соединения

Соединения «в квадратных скобках»
Одним из основателей химии комплексных соединений считается швейцарский химик А. Вернер , предложивший координационную теорию строения комплексных соединений.
- 1704 г. Дисбах – получил берлинскую лазурь KCN . Fe(CN) 2 . Fe(CN) 3
- 1749-1753 гг. Пьер Жозеф Макер получил красную кровяную соль.
Гемоглобин и хлорофилл , без которых невозможно представить жизнь на Земле, – это тоже комплексные соединения.
![Соединения «в квадратных скобках» K 3 [Fe(CN) 6 ] – красная кровяная соль K 4 [Fe(CN) 6 ] –желтая кровяная соль [Ag(NH 3 ) 2 ]OH –аммиачный раствор оксида серебра](https://fsd.videouroki.net/html/2016/02/26/98730734/img2.jpg)
Соединения «в квадратных скобках»
K 3 [Fe(CN) 6 ] – красная кровяная соль
K 4 [Fe(CN) 6 ] –желтая кровяная соль
[Ag(NH 3 ) 2 ]OH –аммиачный раствор оксида серебра
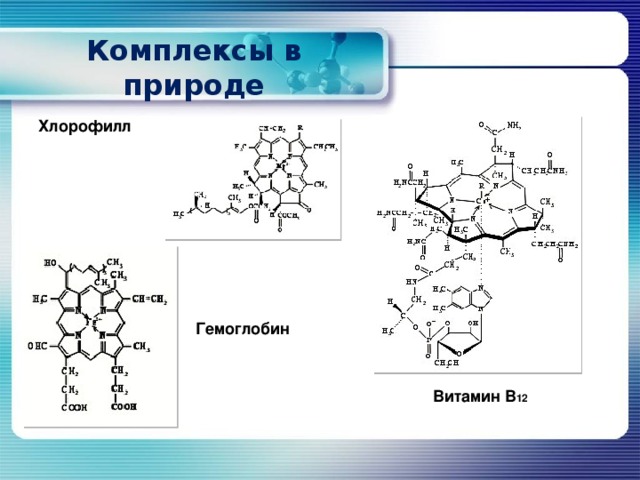
Комплексы в природе
Хлорофилл
Гемоглобин
Витамин В 12
Соединения «в квадратных скобках»
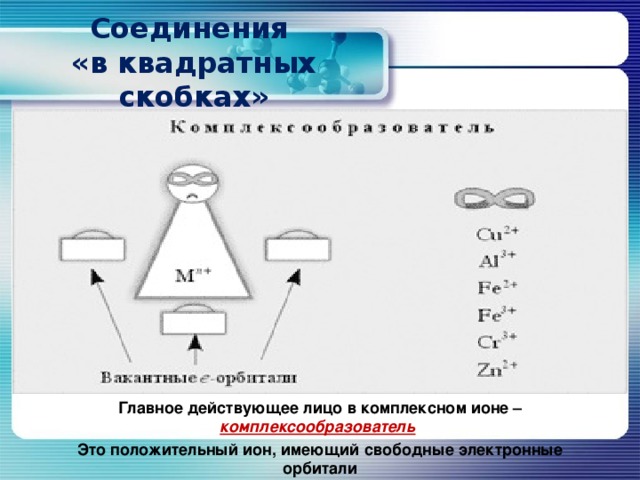
Главное действующее лицо в комплексном ионе – комплексообразователь
Это положительный ион, имеющий свободные электронные орбитали

Кроме комплексообразователя в состав комплексного иона входят лиганды
(от лат. ligo – привязываю)
Соединения «в квадратных скобках»
Лиганды буквально «связаны по рукам» своими неподеленными электронными парами, которые они несут как тяжкий груз.
Лигандами могут быть нейтральные молекулы и отрицательные ионы

Соединения «в квадратных скобках»
Если комплексообразователь принимает неподеленные электронные пары лигандов на свои свободные электронные орбитали, то образуется комплексный ион (и все довольны)
![Строение комплексного соединения Внутренняя сфера Внешняя сфера K 3 [Fe(CN) 6 ] Ион- Комплексо- образователь Координационное число Лиганды [Cu(NH 3 ) 4 ]Cl 2 Внутренняя сфера Внешняя сфера](https://fsd.videouroki.net/html/2016/02/26/98730734/img7.jpg)
Строение комплексного соединения
Внутренняя сфера
Внешняя
сфера
K 3 [Fe(CN) 6 ]
Ион-
Комплексо-
образователь
Координационное
число
Лиганды
[Cu(NH 3 ) 4 ]Cl 2
Внутренняя сфера
Внешняя
сфера

Координационная теория А.Вернера
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
Альфред Вернер
(1866–1919)
Комплексные соединения - вещества, в состав которых входят сложные частицы, содержащие молекулы или сложные ионы, способные к самостоятельному существованию

Альфред Вернер
1866 г. – родился в Мюлузе (Эльзас)
1885 г. – служба в армии в Карлсруэ
1886 г. – 1889 г. Цюрихский политехникум.
1890 г. «О пространственном расположении
атомов в азотсодержащих молекулах»
1891 г. – конкурсная работа на звание приват-доцента «К теории сродства и валентности»
1891 г – стажировка в лаборатории Марселена Бертло
1892 г.-1893 г. – статья «О строении
неорганических соединений»

Лабораторный опыт №1
Шаг 1. Налить в две пробирки по 1 мл раствора соли FeNH 4 (SO 4 ) 2 . Добавить в одну из них несколько капель раствора роданистого аммония NH 4 SCN.
NH 4 SCN
FeNH 4 (SO 4 ) 2

Вопрос:
на наличие какого иона в растворе взятой соли указывает появление красно-бурой окраски?
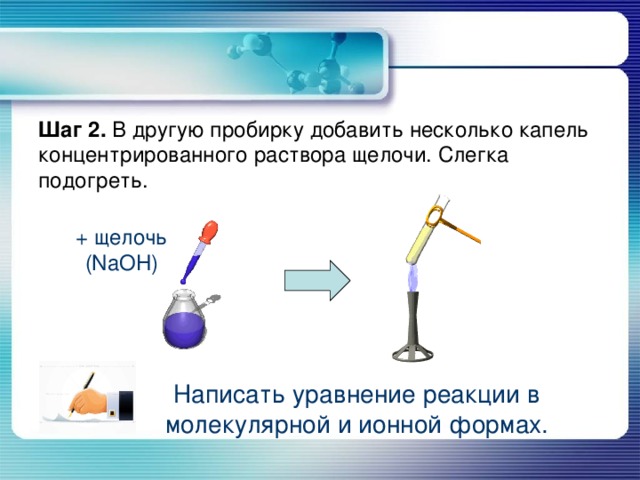
Шаг 2. В другую пробирку добавить несколько капель концентрированного раствора щелочи. Слегка подогреть.
+ щелочь (NaOH)
Написать уравнение реакции в молекулярной и ионной формах.

Вопрос:
на наличие какого иона в растворе взятой соли указывает появление запаха?
Какой солью, двойной или комплексной, является взятое вещество?
 наличие в растворе иона NH 4 + " width="640"
наличие в растворе иона NH 4 + " width="640"
Объяснение опыта:
Тиоцианат (роданид) аммония NH 4 SCN (KSCN) образует с катионом Fe 3+ роданид железа кроваво-красного цвета:
Fe 3+ + 3SCN - → Fe(SCN) 3
При нагревании с щелочами появляется запах аммиака = наличие в растворе иона NH 4 +
![Лабораторный опыт №2 Шаг 1. Налить в пробирку 1 мл раствора соли трехвалентного железа FeCl 3 и добавить несколько капель раствора желтой кровяной соли (железосинеродистого калия K 4 [Fe(CN) 6 ]. Написать молекулярное и ионное уравнения реакции.](https://fsd.videouroki.net/html/2016/02/26/98730734/img15.jpg)
Лабораторный опыт №2
Шаг 1. Налить в пробирку 1 мл раствора соли трехвалентного железа FeCl 3 и добавить несколько капель раствора желтой кровяной соли (железосинеродистого калия K 4 [Fe(CN) 6 ].
Написать молекулярное и ионное уравнения реакции.
![Объяснение опыта: Гексацианоферрат (II) калия K 4 [Fe(CN) 6 ] (желтая кровяная соль) образует с катионом железа Fe 3+ темно-синий осадок «берлинской лазури»: 4Fe 3+ + 3[Fe(CN) 6 ] 4- → Fe 4 [Fe(CN) 6 ] 3 ↓ или KFe[Fe(CN) 6 ] Осадок растворяется в избытке реагента и в сильных кислотах.](https://fsd.videouroki.net/html/2016/02/26/98730734/img16.jpg)
Объяснение опыта:
Гексацианоферрат (II) калия K 4 [Fe(CN) 6 ] (желтая кровяная соль) образует с катионом железа Fe 3+ темно-синий осадок «берлинской лазури»:
4Fe 3+ + 3[Fe(CN) 6 ] 4- → Fe 4 [Fe(CN) 6 ] 3 ↓ или KFe[Fe(CN) 6 ]
Осадок растворяется в избытке реагента и в сильных кислотах.

Лабораторный опыт №3
Шаг 1. Налить в пробирку 1 мл раствора AgNO 3 и добавить столько же раствора NaCl.
Шаг 2. Слить с образовавшегося осадка жидкость. К осадку добавить раствор аммиака. Что наблюдается?
![Объяснение опыта: Раствор хлорида натрия осаждает катионы серебра в виде белого творожистого осадка AgCI. Осадок чернеет на свету, растворим в водном растворе аммиака вследствие образования комплексной соли хлорида диаммин серебра [Ag(NH 3 ) 2 ]CI . AgNO 3 +NaCl=AgCl↓ +NaNO 3 AgCl + 2NH 3 = [Ag(NH 3 ) 2 ]Cl](https://fsd.videouroki.net/html/2016/02/26/98730734/img18.jpg)
Объяснение опыта:
Раствор хлорида натрия осаждает катионы серебра в виде белого творожистого осадка AgCI.
Осадок чернеет на свету, растворим в водном растворе аммиака вследствие образования комплексной соли хлорида диаммин серебра [Ag(NH 3 ) 2 ]CI .
AgNO 3 +NaCl=AgCl↓ +NaNO 3
AgCl + 2NH 3 = [Ag(NH 3 ) 2 ]Cl
![Лабораторный опыт №4 Шаг 1. Налить в пробирку 1 мл раствора FeSO 4 и добавить несколько капель раствора железисинеродистого калия (красной кровяной соли K 3 [Fe(CN) 6 ]). Наблюдать образование синего осадка турнбулиевой сини. Эта реакция является характерной для иона Fe +2 . + K 3 [Fe(CN) 6 ] FeSO 4 Написать уравнение реакции в молекулярной и ионной формах .](https://fsd.videouroki.net/html/2016/02/26/98730734/img19.jpg)
Лабораторный опыт №4
Шаг 1. Налить в пробирку 1 мл раствора FeSO 4 и добавить несколько капель раствора железисинеродистого калия (красной кровяной соли K 3 [Fe(CN) 6 ]). Наблюдать образование синего осадка турнбулиевой сини. Эта реакция является характерной для иона Fe +2 .
+ K 3 [Fe(CN) 6 ]
FeSO 4
Написать уравнение реакции в молекулярной и ионной формах .
![Объяснение опыта: Гексацианоферрат (III) калия K 3 [Fe(CN) 6 ] (красная кровяная соль) образует с катионом железа Fe 2+ синий осадок «турнбулевой сини»: 2[Fe(CN) 6 ] 3- + 3Fe 2+ → Fe 3 [Fe(CN) 6 ] 2 ↓ Осадок не растворяется в кислотах, но разлагается щелочами с выделением гидроксидов железа (II, III).](https://fsd.videouroki.net/html/2016/02/26/98730734/img20.jpg)
Объяснение опыта:
Гексацианоферрат (III) калия K 3 [Fe(CN) 6 ] (красная кровяная соль) образует с катионом железа Fe 2+ синий осадок «турнбулевой сини»:
2[Fe(CN) 6 ] 3- + 3Fe 2+ → Fe 3 [Fe(CN) 6 ] 2 ↓
Осадок не растворяется в кислотах, но разлагается щелочами с выделением гидроксидов железа (II, III).
![Лабораторный опыт №5 Шаг 1. Налить в пробирку 1 мл раствора сернокислой меди и по каплям добавить раствор аммиака. Шаг 2. Прибавить избыток аммиака до растворения осадка. Получается темно-синий раствор, содержащий ионы [Cu(NH 3 ) 4 ]. + р-р NH 3 CuSO 4](https://fsd.videouroki.net/html/2016/02/26/98730734/img21.jpg)
Лабораторный опыт №5
Шаг 1. Налить в пробирку 1 мл раствора сернокислой меди и по каплям добавить раствор аммиака.
Шаг 2. Прибавить избыток аммиака до растворения осадка. Получается темно-синий раствор, содержащий ионы [Cu(NH 3 ) 4 ].
+ р-р NH 3
CuSO 4
 2 ярко-синий раствор](https://fsd.videouroki.net/html/2016/02/26/98730734/img22.jpg)
Объяснение опыта:
Растворы солей меди (II) окрашены в голубой или зеленый цвет.
Водный раствор аммиака при взаимодействии с ионами меди (II) сначала осаждает основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента.
При этом образуется аммиачный комплекс меди сине-фиолетового цвета:
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2
ярко-синий раствор
![Лабораторный опыт №6 Шаг 1. Налить в пробирку 1 мл раствора азотнокислой ртути Hg(NO 3 ) 2 и добавить по каплям разбавленного раствора иодистого калия до появления ярко-оранжевого осадка HgI 2 . Шаг 2. Прилить избыток раствора KI. Осадок растворяется собразованием комплексной соли K 2 [HgI 4 ]. + KI](https://fsd.videouroki.net/html/2016/02/26/98730734/img23.jpg)
Лабораторный опыт №6
Шаг 1. Налить в пробирку 1 мл раствора азотнокислой ртути Hg(NO 3 ) 2 и добавить по каплям разбавленного раствора иодистого калия до появления ярко-оранжевого осадка HgI 2 .
Шаг 2. Прилить избыток раствора KI. Осадок растворяется собразованием комплексной соли K 2 [HgI 4 ].
+ KI

Вопрос: какой цвет комплексного иона?
Написать молекулярное и ионное уравнения реакции.
![Объяснение опыта: Иодид калия образует с ионами Hg оранжево-красный осадок йодида ртути(II) , который в избытке реактива растворяется, образуя в растворе бесцветное устойчивое комплексное соединение тетрайодогидраргерат (II) калия: Hg(NO 3 ) 2 + 2KI = HgI 2 ↓ + 2KNO 3 ; HgI 2 + 2KI = K 2 [HgI 4 ].](https://fsd.videouroki.net/html/2016/02/26/98730734/img25.jpg)
Объяснение опыта:
Иодид калия образует с ионами Hg оранжево-красный осадок йодида ртути(II) , который в избытке реактива растворяется, образуя в растворе бесцветное устойчивое комплексное соединение тетрайодогидраргерат (II) калия:
Hg(NO 3 ) 2 + 2KI = HgI 2 ↓ + 2KNO 3 ;
HgI 2 + 2KI = K 2 [HgI 4 ].

Спасибо за внимание!


 Получите свидетельство
Получите свидетельство Вход
Вход





![Соединения «в квадратных скобках» K 3 [Fe(CN) 6 ] – красная кровяная соль K 4 [Fe(CN) 6 ] –желтая кровяная соль [Ag(NH 3 ) 2 ]OH –аммиачный раствор оксида серебра](https://fsd.videouroki.net/html/2016/02/26/98730734/img2.jpg)




![Строение комплексного соединения Внутренняя сфера Внешняя сфера K 3 [Fe(CN) 6 ] Ион- Комплексо- образователь Координационное число Лиганды [Cu(NH 3 ) 4 ]Cl 2 Внутренняя сфера Внешняя сфера](https://fsd.videouroki.net/html/2016/02/26/98730734/img7.jpg)






 наличие в растворе иона NH 4 + " width="640"
наличие в растворе иона NH 4 + " width="640"
![Лабораторный опыт №2 Шаг 1. Налить в пробирку 1 мл раствора соли трехвалентного железа FeCl 3 и добавить несколько капель раствора желтой кровяной соли (железосинеродистого калия K 4 [Fe(CN) 6 ]. Написать молекулярное и ионное уравнения реакции.](https://fsd.videouroki.net/html/2016/02/26/98730734/img15.jpg)
![Объяснение опыта: Гексацианоферрат (II) калия K 4 [Fe(CN) 6 ] (желтая кровяная соль) образует с катионом железа Fe 3+ темно-синий осадок «берлинской лазури»: 4Fe 3+ + 3[Fe(CN) 6 ] 4- → Fe 4 [Fe(CN) 6 ] 3 ↓ или KFe[Fe(CN) 6 ] Осадок растворяется в избытке реагента и в сильных кислотах.](https://fsd.videouroki.net/html/2016/02/26/98730734/img16.jpg)

![Объяснение опыта: Раствор хлорида натрия осаждает катионы серебра в виде белого творожистого осадка AgCI. Осадок чернеет на свету, растворим в водном растворе аммиака вследствие образования комплексной соли хлорида диаммин серебра [Ag(NH 3 ) 2 ]CI . AgNO 3 +NaCl=AgCl↓ +NaNO 3 AgCl + 2NH 3 = [Ag(NH 3 ) 2 ]Cl](https://fsd.videouroki.net/html/2016/02/26/98730734/img18.jpg)
![Лабораторный опыт №4 Шаг 1. Налить в пробирку 1 мл раствора FeSO 4 и добавить несколько капель раствора железисинеродистого калия (красной кровяной соли K 3 [Fe(CN) 6 ]). Наблюдать образование синего осадка турнбулиевой сини. Эта реакция является характерной для иона Fe +2 . + K 3 [Fe(CN) 6 ] FeSO 4 Написать уравнение реакции в молекулярной и ионной формах .](https://fsd.videouroki.net/html/2016/02/26/98730734/img19.jpg)
![Объяснение опыта: Гексацианоферрат (III) калия K 3 [Fe(CN) 6 ] (красная кровяная соль) образует с катионом железа Fe 2+ синий осадок «турнбулевой сини»: 2[Fe(CN) 6 ] 3- + 3Fe 2+ → Fe 3 [Fe(CN) 6 ] 2 ↓ Осадок не растворяется в кислотах, но разлагается щелочами с выделением гидроксидов железа (II, III).](https://fsd.videouroki.net/html/2016/02/26/98730734/img20.jpg)
![Лабораторный опыт №5 Шаг 1. Налить в пробирку 1 мл раствора сернокислой меди и по каплям добавить раствор аммиака. Шаг 2. Прибавить избыток аммиака до растворения осадка. Получается темно-синий раствор, содержащий ионы [Cu(NH 3 ) 4 ]. + р-р NH 3 CuSO 4](https://fsd.videouroki.net/html/2016/02/26/98730734/img21.jpg)
 2 ярко-синий раствор](https://fsd.videouroki.net/html/2016/02/26/98730734/img22.jpg)
![Лабораторный опыт №6 Шаг 1. Налить в пробирку 1 мл раствора азотнокислой ртути Hg(NO 3 ) 2 и добавить по каплям разбавленного раствора иодистого калия до появления ярко-оранжевого осадка HgI 2 . Шаг 2. Прилить избыток раствора KI. Осадок растворяется собразованием комплексной соли K 2 [HgI 4 ]. + KI](https://fsd.videouroki.net/html/2016/02/26/98730734/img23.jpg)

![Объяснение опыта: Иодид калия образует с ионами Hg оранжево-красный осадок йодида ртути(II) , который в избытке реактива растворяется, образуя в растворе бесцветное устойчивое комплексное соединение тетрайодогидраргерат (II) калия: Hg(NO 3 ) 2 + 2KI = HgI 2 ↓ + 2KNO 3 ; HgI 2 + 2KI = K 2 [HgI 4 ].](https://fsd.videouroki.net/html/2016/02/26/98730734/img25.jpg)










 Комплексные соединения (презентация) (2.19 MB)
Комплексные соединения (презентация) (2.19 MB)
 0
0 2347
2347 156
156 Нравится
0
Нравится
0


