
Модели атомов. Опыт Резерфорда.

Отыщи всему начало, и ты многое поймешь. Козьма Прутков
- 400 г. до н.э. Демокрит: «Существует предел деления атома».
- Аристотель: «Делимость вещества бесконечна».
- 1626 г., Париж: учение об атоме запрещено под страхом смерти

1897г. Д. Д.Томсон определил заряд и массу отдельного «атома» электричества. 1906 – 1914 г.г. А.Ф.Иоффе и Р.Милликен провели эксперименты по точному определению массы и заряда электрона. В природе существует материальный носитель наименьшего заряда – электрон. m e = 9 , 109389 * 10 -31 кг q е =1 ,602177 * 10 – 19 Кл

Модель атома Томсона
Джозеф Джон Томсон в 1904 году предложил модель атома – пудинг (булка с изюмом)

Опыт – отец всякой достоверности, мудрость – дочь опыта. Леонардо да Винчи
- 1911 г. Эрнест Резерфорд поставил опыт по зондированию атома
α – частицами.
- Цель: исследовать распределение «+» заряда и массы внутри атома.
- Действительно ли положительный заряд распределен по всему объему атома с постоянной плотностью?



Схема Опыта Резерфорда

Планетарная модель атома
Выводы:
- В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны.
- Основная масса атома сосредоточена в ядре m ядра = 99,4% m атома.
- D атома ~ 10 –10 м
- D ядра ~ 10 -14 - 10 – 15 м
- Атом электрически нейтрален – абсолютное значение суммарного отрицательного заряда электронов равно положительному значению заряда ядра.
- q ядра = + N e ;
Строение атома
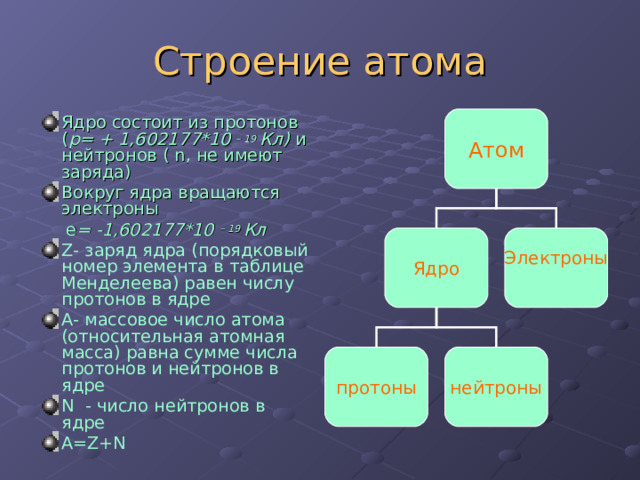
Атом
- Ядро состоит из протонов ( р = + 1 ,602177 * 10 – 19 Кл) и нейтронов ( n , не имеют заряда)
- Вокруг ядра вращаются электроны
е = - 1 ,602177 * 10 – 19 Кл
- Z- заряд ядра (порядковый номер элемента в таблице Менделеева) равен числу протонов в ядре
- А- массовое число атома (относительная атомная масса) равна сумме числа протонов и нейтронов в ядре
- N - число нейтронов в ядре
- А= Z+N
Ядро
Электроны
протоны
нейтроны

Массовое число атома ( А )
7
Li
3
Заряд ядра ( Z )

Задания:
1
1
2
1. Положительно заряженная ядерная частица.
2. Число нейтронов в атоме натрия.
3. Какая из элементарных частиц была обнаружена первой?
4. Сколько электронов в атоме азота?
5. Мельчайшая химически неделимая частица вещества.
3
9
4
5
6
10
7
8
6. Часть атома, в котором сосредоточена вся его масса.
7. Сколько нейтронов в ядре протия?
8. Атомы одного химического элемента с различной атомной массой.
9. Элементарная частица, не имеющая заряда.
10. Массовое число бериллия.

п
1
р
д
2
в
о
э
л
е
т
р
о
н
к
3
9
о
н
е
с
4
й
н
а
е
т
м
д
о
а
5
р
ь
ц
р
о
д
я
6
10
а
е
7
ь
л
о
н
т
в
ь
я
и
о
з
п
о
т
8
ь

 Получите свидетельство
Получите свидетельство Вход
Вход












 Модели атомов. Опыт Резерфорда. (1.62 MB)
Модели атомов. Опыт Резерфорда. (1.62 MB)
 0
0 120
120 2
2 Нравится
0
Нравится
0


