
Обратимость химических реакций
Химическое равновесие

Химические реакции (ХР)
необратимые
обратимые
(их немного)
- горение
- ионные р-ции
в растворах
(их большинство)
2SO2 + O2 = 2SO3

Обратимые и необратимые реакции
- Необратимыми называют химические реакции, протекающие только в одном направлении.
- Обратимыми называют реакции, протекающие при одних и тех условиях и в прямом, и в обратном направлениях.

Необратимые ХР
- это ХР, в результате которых исходные вещества практически полностью превращаются в конечные продукты.
(выделение газа)
(выпадение осадка)
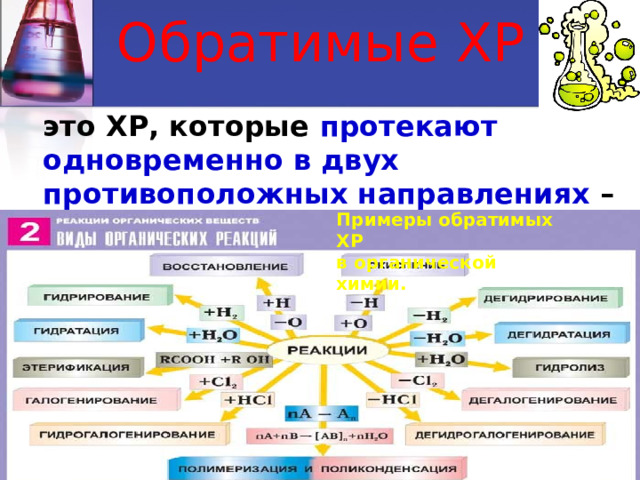
Обратимые ХР
это ХР, которые протекают одновременно в двух противоположных направлениях – прямом и обратном.
Примеры обратимых ХР
в органической химии.
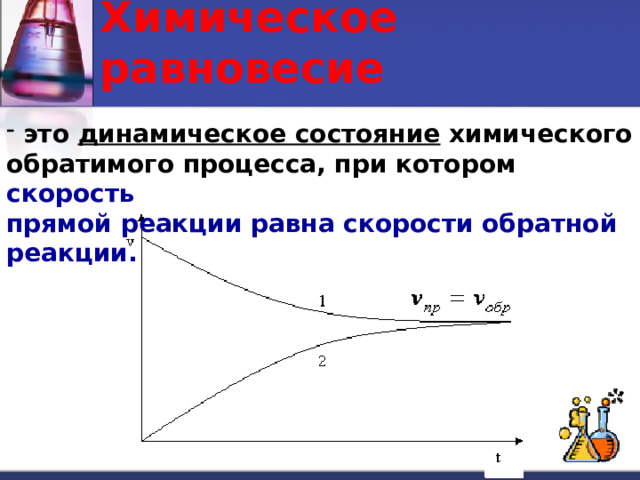
Химическое равновесие
- это динамическое состояние химического
обратимого процесса, при котором скорость
прямой реакции равна скорости обратной
реакции.

- Концентрации всех веществ в состоянии равновесия (равновесные концентрации) постоянны.
- Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.

Смещение химического равновесия
- Принцип Ле Шателье (1884г.):
если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
![Для одностадийной обратимой реакции при равновесии выражения для скоростей прямой V 1 и обратной реакций V 2 имеют вид: где [a], [b], [c] и [d] - равновесные молярные концентрации веществ a, b, c и d; a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.](https://fsd.videouroki.net/html/2022/12/19/v_63a00d6923f77/img8.jpg)
- Для одностадийной обратимой реакции
- при равновесии выражения для скоростей прямой V 1 и обратной реакций V 2 имеют вид:
- где [a], [b], [c] и [d] - равновесные молярные концентрации веществ a, b, c и d; a,b,c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 и k2 -коэффициенты пропорциональности, называемые константами скоростей.

- Из условия равновесия V 1 =V 2 следует:
- Отсюда получаем выражение для константы равновесия Kp :
- Чем выше величина Kp , тем больше в равновесной смеси продуктов прямой реакции .
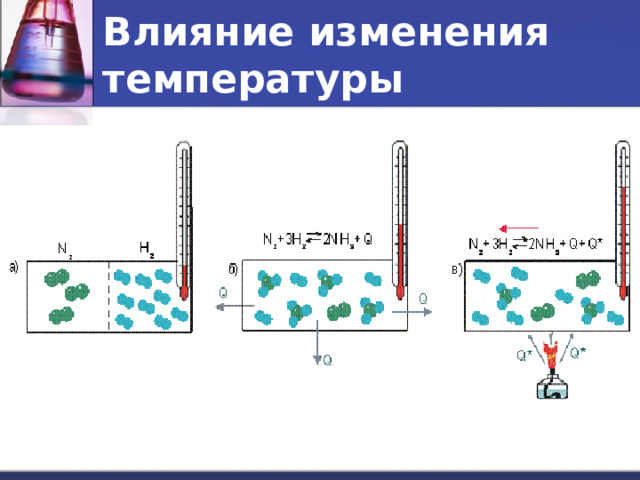
Влияние изменения температуры

Влияние изменения температуры
N 2 (г) + 3H 2 (г) → 2NH 3 (г) + Q

Влияние изменения температуры
- При повышении температуры равновесие смещается в сторону эндотермической реакции.
- При понижении температуры – в сторону экзотермической реакции.
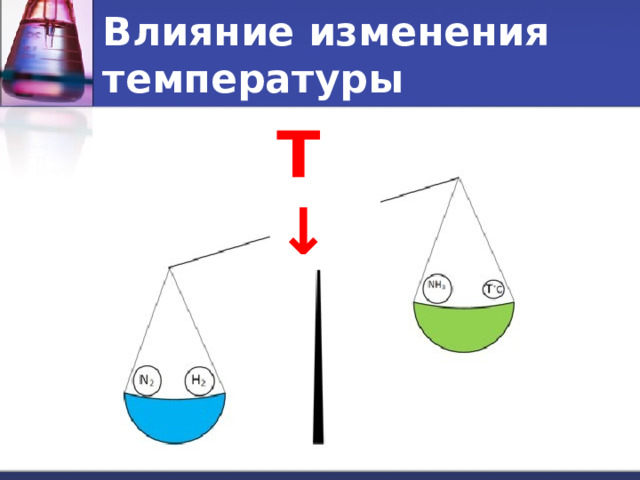
Влияние изменения температуры
T ↓

Закрепление знаний:
- Стр. 147 – упр.1-а

Влияние изменения концентрации веществ
- При увеличении концентрации одного из веществ равновесие смещается в сторону его расходования.
- При уменьшении концентрации – в сторону его образования.
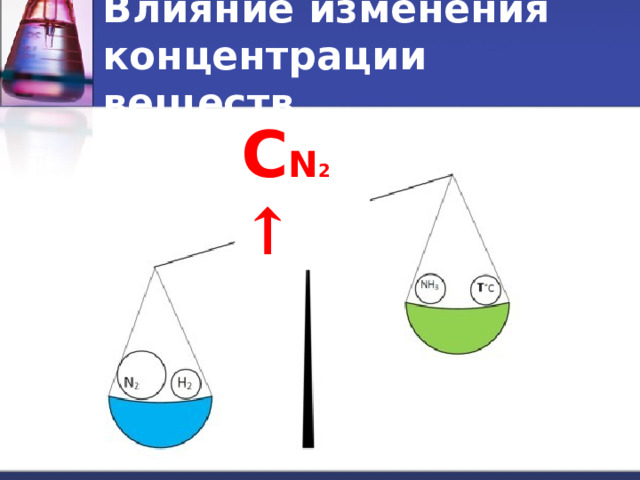
Влияние изменения концентрации веществ
С N 2 ↑

Закрепление знаний:
- Стр. 147 – упр.3-а

Влияние изменения давления
- При увеличении давления равновесие смещается в сторону той реакции, при которой объем образующихся газов меньше .
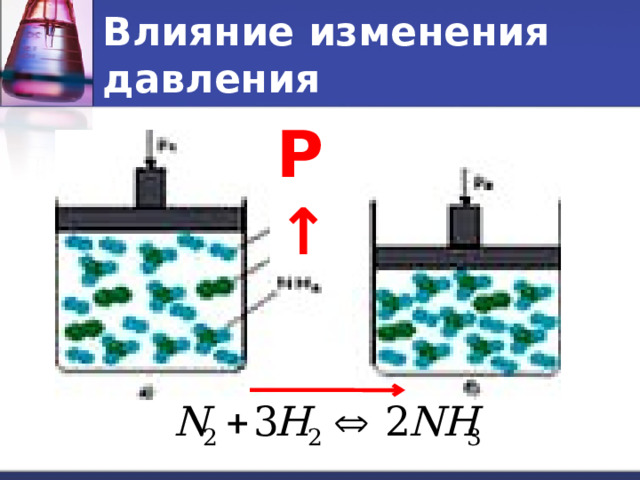
Влияние изменения давления
Р↑

Закрепление знаний:
- Стр. 147 – упр.2, 4

Катализатор:
- не влияет на смещение химического равновесия
(он лишь ускоряет процесс его достижения)

Принцип Ле Шателье:
применим к любым равновесным системам:
- термодинамическим
- биологическим
- психическим
- педагогическим
- социальным
- экономическим
![Задание в зачётный лист 1. Какое изменение параметров (температура - t , давление - p или концентрация веществ - [A] ) будет способствовать сдвигу хим. равновесия влево (в сторону образования исходных веществ) для реакций: А) N2 + O2 = 2NO – Q Б) 2SO2 + O2 = 2SO3 + Q](https://fsd.videouroki.net/html/2022/12/19/v_63a00d6923f77/img23.jpg)
Задание в зачётный лист
1. Какое изменение параметров (температура - t , давление - p или концентрация веществ - [A] ) будет способствовать сдвигу хим. равновесия влево (в сторону образования исходных веществ) для реакций:
А) N2 + O2 = 2NO – Q
Б) 2SO2 + O2 = 2SO3 + Q

2. В системе
2CO (г) + O 2 (г) 2CO 2 (г) + Q
смещению химического равновесия в сторону исходных веществ будет способствовать
1) увеличение давления
2) увеличение концентрации оксида углерода (IV)
3) уменьшение температуры
4) увеличение концентрации кислорода

3. Давление не влияет на равновесие в реакции:

4. В какой системе увеличение давления и понижение температуры смещает химическое равновесие в сторону продуктов реакции?
1) 2SO2(г) + O2(г) 2SО3(г) + Q
2) N2(г) + О2(г) 2NO(г) – Q
3) CO2(г) + 2C(тв.) 2CO(г) – Q
4) 2NH3(г) N2(г) + 3H2(г) – Q

5 задание
1) повысив температуру
2) применив катализатор
3) понизив концентрацию водорода
4) повысив давление

6. В равновесной системе
равновесие сместится в сторону исходных веществ при
1) повышении температуры и повышении давления
2) понижении температуры и повышении давления
3) повышении температуры и понижении давления
4) понижении температуры и понижении давления

7. В состоянии химического равновесия
1) скорости прямой и обратной реакций равны нулю
2) концентрация исходных веществ равна концентрации продуктов
реакции
3) скорость прямой реакции равна скорости обратной реакции
4) число молекул исходных веществ равно числу молекул продуктов реакции

8 задание:

9. Давление не влияет на химическое равновесие в системе:

10 задание:

11. В какой системе при повышении давления химическое равновесие сместится в сторону исходных веществ?
1) N 2 (г) + 3H 2 (г) 2NH 3 (г) + Q
2) N 2 O 4 (г) 2NO 2 (г) – Q
3) CO 2 (г) + H 2 (г) CO (г) + H 2 O(г) – Q
4) 4HCl(г) + O 2 2H 2 O(г) + 2Cl 2 (г) + Q

12 задание:

Д/з:
- Параграф 14 , читать
- Упр. 1-б, 3-б,в.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Обратимость химических реакций (788.32 KB)
Обратимость химических реакций (788.32 KB)
 0
0 380
380 7
7 Нравится
0
Нравится
0


