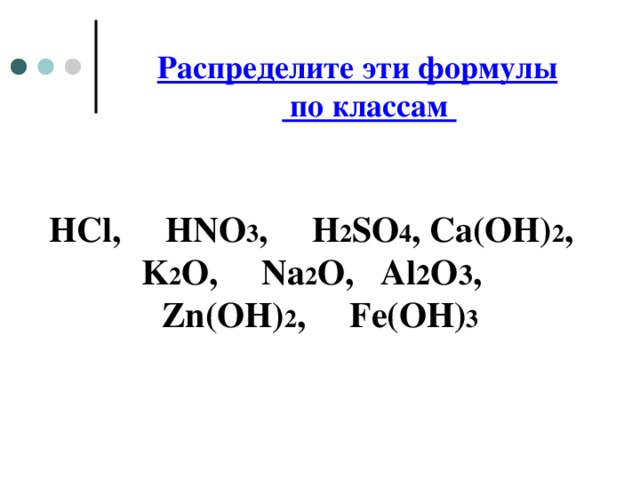
Распределите эти формулы по классам
HCl, HNO 3 , H 2 SO 4 , Ca(OH) 2 , K 2 O, Na 2 O, Al 2 O 3 , Zn(OH) 2 , Fe(OH) 3
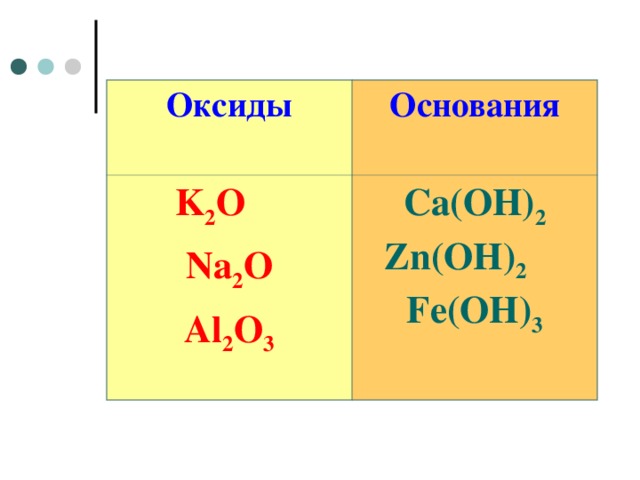
Оксиды
Основания
K 2 O
Na 2 O
Al 2 O 3
Ca(OH) 2 Zn(OH) 2 Fe(OH) 3

Выполнила:
Учитель биологии и химии
МБОУ ООШ№3 г.Бикин
Хабаровский край
Мазунина Ю.Ю.

Что должны узнать на уроке:
- какие бывают кислоты,
- какая формула кислоты,
- как их классифицируют,
- как составляют название,
- уметь распознавать кислоты среди других соединений,
- знать правила техники безопасности при работе с кислотами.

По происхождению кислоты бывают
ОРГАНИЧЕСКИЕ –
ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ.

НЕОРГАНИЧЕСКИЕ
СЕРНАЯ, СОЛЯНАЯ, ПЛАВИКОВАЯ, ФОСФОРНАЯ, АЗОТНАЯ.

КИСЛОТЫ СОДЕРЖАТСЯ В ОРГАНИЗМАХ ЖИВОТНЫХ
Молочная кислота
образуется в мышцах при физической нагрузке.
Муравьиная кислота
КИСЛОТЫ ПРИМЕНЯЮТСЯ В МЕДИЦИНЕ
Аскорбиновая,
фолиевая,
липоевая,
ацетил-
салициловая
и другие

КИСЛОТЫ ПРИМЕНЯЮТСЯ В КУЛИНАРИИ
Уксусная
и
лимонная кислоты.

ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Индикатор
Окраска индикатора в растворе соляной кислоты ( HCl )
лакмус
Окраска индикатора в лимонной кислоте
Фенолфталеин
Метилоранж
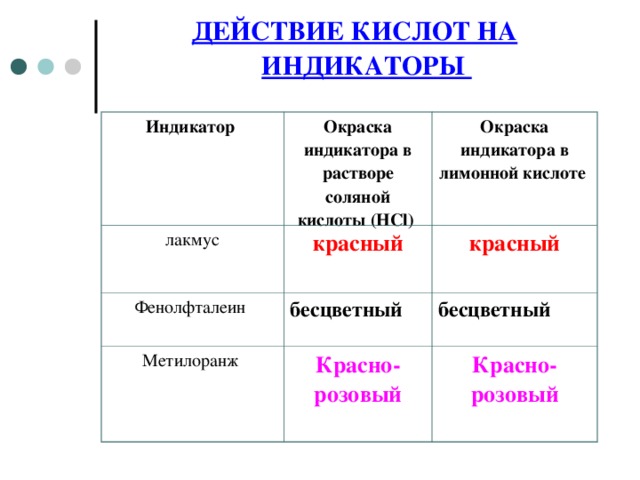
ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ
Индикатор
Окраска индикатора в растворе соляной кислоты ( HCl )
лакмус
Окраска индикатора в лимонной кислоте
красный
Фенолфталеин
бесцветный
красный
Метилоранж
бесцветный
Красно-розовый
Красно-розовый

Прочитайте формулы кислот
H Cl , H 2 S O 4 , H 3 P O 4
Что общего во всех этих формулах?
все общие свойства кислот,
в том числе изменение окраски индикаторов,
связаны с элементом водородом.
Остальная часть молекулы
называется кислотным остатком .
Специфические свойства каждой кислоты связаны с наличием разных кислотных остатков

Кислоты
– это сложные вещества, состоящие из ионов водорода и кислотного остатка.

А чем еще кроме разных кислотных остатков отличаются эти кислоты ?
H Cl , H 2 S O 4 , H 3 P O 4
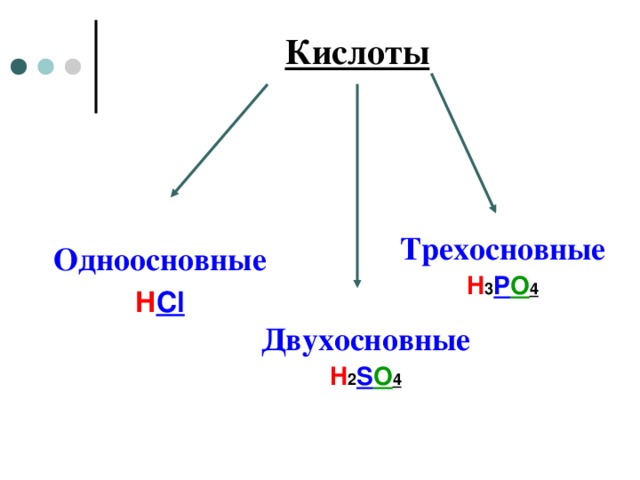
Кислоты
Трехосновные
H 3 P O 4
Одноосновные
H Cl
Двухосновные
H 2 S O 4
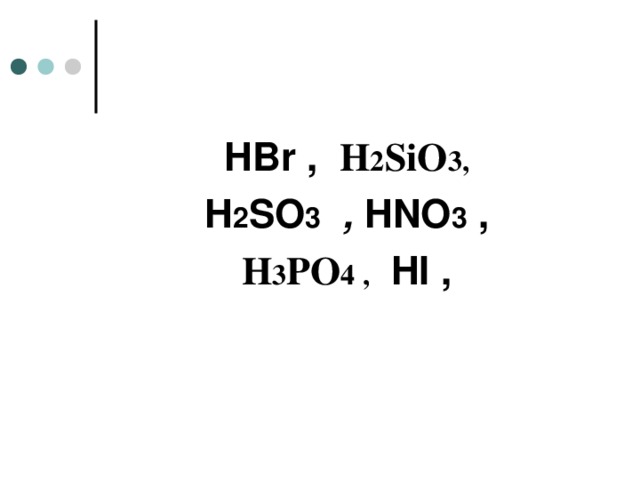
HBr , H 2 SiO 3 ,
H 2 SO 3 , HNO 3 ,
H 3 PO 4 , HI ,

ЧЕМ ОТЛИЧАЮТСЯ КИСЛОТНЫЕ ОСТАТКИ ЭТИХ КИСЛОТ ?
H Cl , H 2 S O 4
H F , H N O 3
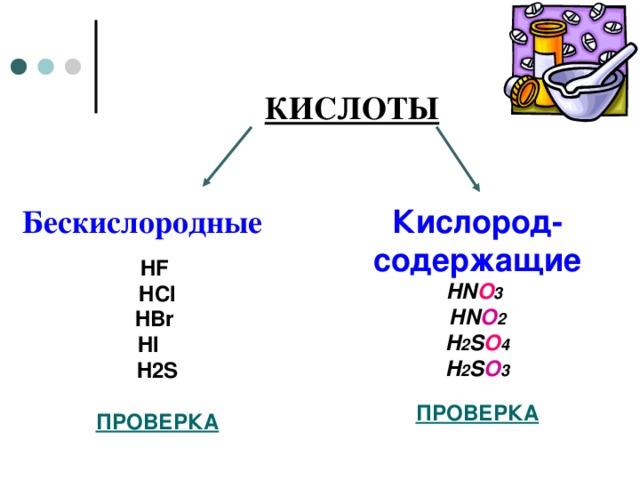
КИСЛОТЫ
Бескислородные
Кислород-содержащие
HN O 3
HN O 2
H 2 S O 4
H 2 S O 3
ПРОВЕРКА
HF
HCl
HBr
HI
H2S
ПРОВЕРКА

НОМЕНКЛАТУРА КИСЛОТ
Бескислородные кислоты:
К названию кислотообразующего элемента добавляют гласную « о »
и слова « водородная кислота »
H Cl – хлор о водородная кислота

Кислородсодержащие кислоты:
К русскому названию кислотообразующего элемента добавляют суффикс :
Если элемент проявляет высшую СО ( равную № группы)
+ 6
– «-ная»: H 2 SO 4
сер ная кислота
Если СО элемента ниже высшей + 4
– «-истая»: H 2 SO 3
серн истая кислота

ПРОВЕРЬ СЕБЯ
1.Формула кислоты это:
А) NaOH В) CuCL 2
Б) HCL Г) SO 3
2. Двухосновной кислотой является:
А ) HCl В ) HNO 3
Б ) H 2 SO 4 Г ) H 3 PO 4
3. Цвет лакмуса в кислой среде:
А ) красный В ) оранжевый
Б ) фиолетовый Г ) бесцветный
4. Бескислородной кислотой является:
А ) HF В ) HNO 3
Б ) H 2 SO 4 Г ) H 3 PO 4
5 . Фенолфталеин в кислой среде:
А ) красный В ) оранжевый
Б ) фиолетовый Г ) бесцветный

Ответы:
1. Б
2. Б
3. А
4. А
5. Г

Домашнее задание
§ 20, учить формулы и названия кислот, подготовиться к химическому диктанту
Упр. 1,3, 5


 Получите свидетельство
Получите свидетельство Вход
Вход



































 Презентация к уроку химии "Кислоты" (0.72 MB)
Презентация к уроку химии "Кислоты" (0.72 MB)
 0
0 519
519 67
67 Нравится
0
Нравится
0


