
Скорость химических реакций
- быстрота ее протекания
- изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства.


Гомогенные реакции Ж+Ж Г+Г Гетерогенные реакции Т+Т Т+Ж Т+Г Г+Ж

Гомогенные реакции — Ж+Ж, Г+Г
Гетерогенные реакции — Т+Т Т+Ж Т+Г Г+Ж
Гомогенные реакции — Ж+Ж, Г+Г
Гетерогенные реакции — Т+Т Т+Ж Т+Г Г+Ж
Гомогенные реакции — Ж+Ж, Г+Г
Гетерогенные реакции — Т+Т Т+Ж Т+Г Г+Ж

Реакция протекает по уравнению
А+В = 2С.
Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.

Факторы, влияющие на скорость химической реакции
Теория активных столкновений:
1. Реакция происходит при столкновении частиц реагентов, которые обладают определенной энергией
2. К реакции приводят лишь эффективные соударения, т. е. такие, при которых разрушаются старые связи образуются новые.
3. Минимальный запас энергии, которым должны обладать молекулы исходных веществ, чтобы соударения между ними были эффективными, называется энергетическим барьером реакции (Еа — энергия активации).
Чем ниже этот энергетический барьер, тем больше частиц могут его преодолеть, тем выше Vхр
С. Аррениус, 1889 г
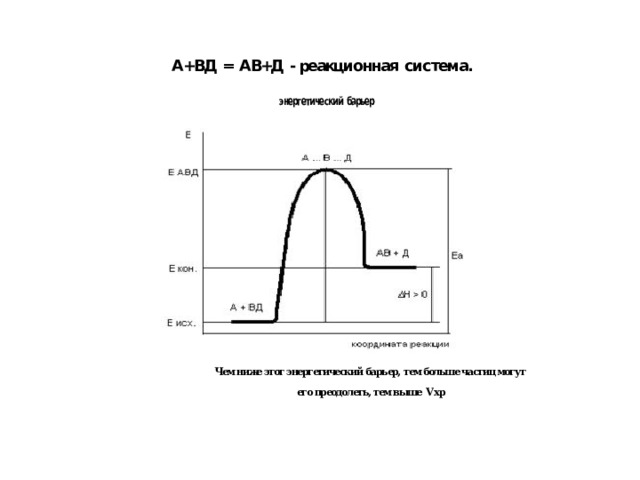
его преодолеть, тем выше Vхр

Факторы, влияющие на скорость химической реакции
Фактор, влияющий на скорость
Действие фактора
Пример

Факторы, влияющие на скорость химической реакции
- Температура
При увеличении температуры скорость реакции увеличивается.
С чем это связано?

В XIX веке голландский ученый Вант-Гофф опытным путем обнаружил, что при
повышении температуры на 10 о С скорости многих реакций возрастают в 2-4 раза.
Якоб Вант-Гофф
(1852-1911)
Правило Вант-Гоффа
При нагревании системы на 10 ˚С
скорость реакции возрастает в 2-4 раза
- - температурный коэффициент
Вант-Гоффа

- ( греческая буква «гамма» ) - температурный коэффициент -
-число, показывающее, во сколько раз увеличивается скорость реакции
при повышении температуры на 10° С (принимает значения от 2 до 4).
Для каждой конкретной реакции температурный коэффициент определяется
опытным путем.
При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~ 1,6 %,
а скорость реакции увеличивается в 2-4 раза
(на 100-300%).

Как изменится скорость гомогенной реакции при повышении температуры от 60º до 90º при температурном коэффициенте, равном 4?

Факторы, влияющие на скорость химической реакции
2. Природа реагентов:
чем активнее реагирующие вещества, тем быстрее они взаимодействуют друг с другом.
Самые быстрые реакции – гомогенные , протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме смеси реагентов.
Самые быстрые реакции – гомогенные , протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме сме

Задания:
1. С наибольшей скоростью при комнатной температуре протекает реакция меду водородом и 1) серой 2) иодом 3) фтором 4) бромом
2. С наибольшей скоростью при обычных условиях протекает реакция
1) 2Ba + O 2 = 2BaO 2) Ba 2+ + CO 3 2- = BaCO 3 ↓
3) Ba + 2H + = Ba 2+ + H 2 4) Ba + S = BaS

Факторы, влияющие на скорость химической реакции
3. Концентрация реагентов(!)
При увеличении концентрации реагентов скорость увеличивается.
С чем это связано?
Самые быстрые реакции – гомогенные , протекающие в одной фазе (газы или смешивающиеся жидкости). В них взаимодействие происходит во всем объеме сме

Зависимость скорости от концентрации реагентов выражается Законом Действующих Масс - основной закон химической кинетики. Х имическая кинетика — наука о закономерностях протекания химических реакций во времени.
ЗДМ : Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов.
(«действующая масса» – синоним современного понятия «концентрация»)
аА + bВ = cС +dD
V=k c a (A ) c b (B) — кинетическое уравнение
к-константа скорости химических реакций

ЗДМ относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k.
Запишите кинетическое уравнение для следующих уравнений реакций:
А) S(тв) + O 2 (г) = SO 2 (г)
Б) 2SO 2 (г) + O 2 (г) = 2SO 3 (ж)

Факторы, влияющие на скорость химической реакции
4. Давление - только для газов!
( Жидкости и твердые тела практически несжимаемы и давление не влияет на их концентрации. )
- Как изменится объем реакционной системы при увеличении давления?
- Как при этом изменится концентрация реагентов?
- Что произойдет со скоростью реакции?

Как изменится скорость реакции:
S (тв) + O2 (г) = SO2 (г)
при увеличении давления в системе в 4 раза?

Как изменится скорость реакции:
2SО2 (г) + O2 (г) = 2SO3 (г)
при увеличении давления в системе в 2 раза?

Факторы, влияющие на скорость химической реакции
5. Площадь соприкосновения реагирующих веществ.
Для увеличения скорости химической реакции
Fe ( тв ) + 2H + ( раств ) → Fe 2+ + H 2 ↑ необходимо:
1) добавить несколько кусочков железа,
2) увеличить концентрацию ионов железа,
3) уменьшить температуру,
4) измельчить взятое железо.

Чем сильнее измельчено твердое вещество, тем выше скорость реакции.
Почему?

Чем сильнее измельчено твердое вещество, тем, больше площадь соприкосновения реагирующих частиц, тем выше скорость реакции.
Пример - горение древесины.
Целое полено горит на воздухе сравнительно медленно. Если увеличить поверхность соприкосновения дерева с воздухом, расколов полено на щепки, скорость горения
увеличится.

.
Добавление новой порции твердого реагента на скорость химической влияет незначительно!
Исключение: скорость реакции возрастает при добавлении твердого, но РАСТВОРИМОГО реагента , если реакция протекает с участием растворов

Факторы, влияющие на скорость химической реакции
6. Использование катализаторов и ингибиторов.
Катализатор – вещество, увеличивающее скорость реакции, но не расходующееся в ней.
Ингибитор – это «катализатор наоборот», он замедляет реакцию.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Скорость химической реакции ЕГЭ (437 KB)
Скорость химической реакции ЕГЭ (437 KB)
 0
0 311
311 14
14 Нравится
0
Нравится
0






