Различают ковалентную, ионную, металлическую химические связи. Ковалентная связь образуется за счёт образования общих электронных пар в межъядерном пространстве. Она образуется в основном между атомами неметаллов. Например: I2, CO2, HCl, CH4.
Но к ковалентным соединениям относятся также соединения, которые состоят из атома кислорода и атома металла в степени окисления +5 и выше. Это кислотные оксиды металлов. Например: Mn2O7, CrO3, OsO4.
Ковалентную связь делят на полярную и неполярную. Ковалентная неполярная связь образована атомами одного неметалла. Например: H2, N2, F2, P4, S8. В ковалентной неполярной связи общая электронная пара в равной степени принадлежит обоим атомам, так как образуется между атомами неметаллов с одинаковой электроотрицательностью.
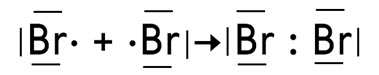
Так, в молекуле Br2 образовалась одна общая электронная пара. Эта связь всегда будет σ-типа. Когда образуется молекула О2, то здесь появляется двойная связь, так как две общие электронные пары. Эта связь называется двойной и состоит из σ- и π-связи. В молекуле азота тройная связь, так как образуется три общие электронные пары. Эта связь состоит из одной σ-, и двух π-связей. Такие двойные и тройные связи называются кратными.

Связи σ-типа образуются с участием атомных орбиталей всех типов: s-, p-, d. При этом атомные орбитали перекрываются вдоль линии, соединяющей ядра атомов. Связи π-типа образуются только при участии p- или d-орбиталей, причём атомные орбитали здесь перекрываются вне линии, соединяющей ядра атомов.
Ковалентная полярная связь образована атомами различных неметаллов. Например: CH4, NH3, H2O, SiC, SO3.
В ковалентной полярной связи общая электронная пара смещена к атому с большей электроотрицательностью, в результате чего у одного атома появляется частично положительный заряд, а у другого – частичный отрицательный заряд. Чем больше различия в электроотрицательности, тем больше частичные заряды (δ), тем более полярная связь.
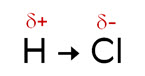
Так в ряду H2Se, H2S, H2O полярность связи возрастает, так как разница в электроотрицательности увеличивается, а также возрастает энергия связи, так как размеры взаимодействующих атомов уменьшаются и уменьшается длина связи.
Среди ковалентных соединений выделяют соединения, содержащие только одинарные σ-связи. Например: Br2, H2O, C2H6, H2S.
Другие ковалентные соединения имеют как σ, так и π-связи. Например: O2, N2, H2SO4, C6H6, CH3CHO.
Есть ковалентные соединения, которые одновременно содержат и ковалентную неполярную связь и ковалентную полярную связи. Например: H2O2, C2H2, N2H4, C6H6.
Cледует запомнить, что чем больше кратность связи, тем меньше её длина и больше энергия. Например, в молекулах CO, CO2, CH3 – OH, длина связи углерод-кислород растёт, а её энергия уменьшается.
Рассмотренный механизм образования ковалентной связи назывался обменным, потому что каждый атом предоставляет на образование связи по одному или несколько неспаренных валентных электронов. Но есть ещё и донорно-акцепторный механизм образования ковалентной связи, при котором один из атомов предоставляет на образование связи пару электронов – это атом донор, а другой предоставляет вакантную орбиталь – это атом акцептор. Связь, образованная по донорно-акцепторному механизму, присутствует в составе: NH4+, H3O+, CO, BF, BF4-, BH4-, HNO3, N2O5, H3N · BF3, N2H4, NH2OH, соли аминов. При этом основными донорами электронных пар являются О и N, но О донор в СО, а акцептор в HNO3 и в N2O5. Основными акцепторами являются H+, B и С в СО.
Рассмотри механизм образования иона аммония. Атом азота в NH3 имеет неподелённую пару электронов, а ион Н+ – свободную орбиталь, неподелённая пара электронов от азота переходит на свободную орбиталь и образуется ион NH4+.
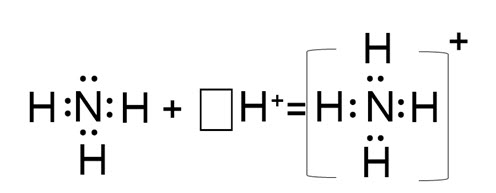
Ионные соединения могут содержать только ионную связь, как некоторые бинарные соединения. К таким соединениям относятся бинарные соединения металлов с галогенами, халькогенами, водородом, азотом, фосфором и углеродом. Например: CuCl2, Na2S, KH, Ca3N2, Mg3Р2, Al4C3. К ионным соединениям, имеющим только ионную связь относятся основные и амфотерные оксиды. Например: BaO, Al2O3.
Ионные соединения могут иметь в составе ионную и ковалентную неполярную связи. К таким соединениям относятся дисульфиды (FeS2), пероксиды (K2O2), ацетилениды (CaC2). К ионным соединениям относятся соединения, содержащие ионную и ковалентную полярную связи. Например: основания (Ca(OH)2), соли аммония (NH4NO3), соли металлов со сложными анионами (Na2SO4), соли аминов и аминокислот (CH3NH3Cl), алкоголяты (CH3ONa), феноляты (C6H5OK).
Как правило, ионная связь образуется между типичными металлами и типичными неметаллами. Например, в KI.
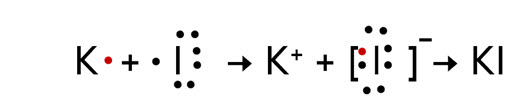
Металлическая связь возникает между атомами в металлическом кристалле и обусловлена притяжением катионов и свободных электронов. Эта связь образуется в металлах и сплавах.
Различают ионную, металлическую, атомную и молекулярную кристаллическую решётки. Если связь в соединении ионная, то и кристаллическая решётка всегда ионного типа. Например: KNO3, Ca3N2, Al2O3. Если связь металлическая, то и кристаллическая решётка всегда металлическая. Например: латунь, Fe, Cu. Если связь ковалентная, то кристаллическая решётка может быть атомной и молекулярной. Нужно запомнить вещества с атомной кристаллической решёткой. В ковалентной полярной связи это: SiC, SiO2, а в ковалентной неполярной связи – это B, Si, алмаз, графит, чёрный и красный фосфор. Все остальные вещества с ковалентной связью имеют молекулярную кристаллическую решётку.
У веществ с ионным типом связи в узлах кристаллической решётки находятся ионы, связь между ними прочная, эти вещества тугоплавкие и нелетучие, твёрдые и хрупкие, многие растворимы в воде. Они плохо проводят электрический ток и теплоту, а растворы и расплавы их¸ как правило, проводят электрический ток. Эти вещества не имеют запаха. Вещества с металлическим типом связи в узлах кристаллической решётки имеют ионы металлов. Прочность связи у них различная. Эти вещества хорошо проводят электрический ток и тепло. Многие из них пластичны. Имеют характерный металлический блеск. У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки находятся молекулы. Прочность связи у этих веществ небольшая. У них низкие температуры кипения и плавления, они летучи, иногда имеют запах, для некоторых характерна сублимация (возгонка), как для йода и твёрдого СО2. Для этих веществ характерна также небольшая твёрдость, а многие из них хорошо растворимы в воде. У веществ с атомной кристаллической решёткой в узлах кристаллической решётки находятся атомы, поэтому связь между атомами очень прочная, у этих веществ высокие температуры кипения и плавления, они нелетучи, очень твёрдые и практически не растворимы в воде, они не имеют запаха.
Водородную связь следует рассматривать, как вид межмолекулярной связи или частный случай ковалентной полярной связи. Она образуется при выполнении двух условий. Во-первых, в молекуле должен быть атом Н, во-вторых, атом Н должен быть связан в атомом F, O, N. Энергия водородной связи меньше, чем химической связи, но больше чем обычного межмолекулярного взаимодействия. Внутримолекулярная водородная связь соединяет различные части одной и той же молекулы. Такая внутримолекулярная водородная связь присутствует в молекулах белков, салициловой кислоте, нуклеиновых кислотах и так далее. Межмолекулярная водородная связь образуется между атомом Н одной молекулы и атомами F, O, N другой молекулы того же или другого вещества. Такая связь образуется между молекулами HF, CH3COOH, H2O и других
Таким образом, в молекулах HF, H2O, CH3COOH и других присутствуют не только ковалентные полярные связи, но и водородные. Водородная связь повышает взаимную растворимость веществ, повышает температуры плавления и кипения, а для воды приводит ещё и к высокому значению теплоёмкости.
Следует различать понятия «валентность» и «степень окисления». Валентность – это мера способности атома соединяться с другими атомами. То есть равна числу ковалентных связей, образованных данным атомом. Валентность – это целостное значение, знака не имеет и обозначается римскими цифрами. А степень окисления – это условный заряд атома в соединении, если предположить, что все образованные им связи являются ионными. Степень окисления может быть нулевой, дробной и целой, положительной и отрицательной, обозначается арабскими цифрами.
Численные (по модулю) значения валентности и степени окисления в большинстве случаев совпадают, например, в молекуле H2O, NH3. Но есть случаи, когда они не совпадают. Например, в молекуле Н2О2 В (О) = II, СО (О) = -1; в молекуле N2H4 В (N) = III, CO (N) = -2; в молекуле СО В (С) = В(О) = III, СО ( С) = +2, СО (О) = -2; в молекуле HNO3 B (N) = IV, CO (N) = +5; в молекуле N2O5 B (N) = IV, CO (N) = +5; в ионе NH4+ B (N) = IV, CO (N) = -3; в ионе H3O+ B (O) = III, CO (O) = -2; в молекуле N2 B (N) = III, CO (N) = 0; в молекуле O2 B(O) = II, CO (O) = 0.

 Получите свидетельство
Получите свидетельство Вход
Вход





 924
924

