Существует несколько критериев классификации химических реакций. В неорганической химии по числу и исходных веществ и продуктов реакции делятся на реакции соединения, разложения, замещения и обмена:
4NO2 + O2 + 2H2O = 4HNO3
2KMnO4 = K2MnO4 + MnO2 + O2↑
Zn + FeSO4 = ZnSO4 + Fe
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4.
Важно помнить, что в реакции соединения могут вступать как простые, так и сложные вещества, реакции разложения характерны только для сложных веществ, в реакции замещения вступает одно простое и одно сложное вещество, а в реакции обмена – два сложных вещества, которые обмениваются своими составными частями.
По тепловому эффекту реакции делят на экзотермические, которые протекают с выделением тепла, и эндотермические, которые идут с поглощением тепла:
CH4 + 2O2 = CO2↑ + 2H2O + Q
CaCO3 = CaO + CO2↑ - Q.
Из этих реакций видно, что реакции горения, как правило, идут с выделением тепла, а реакции разложения – с поглощением.
По направлению протекания реакции их делят на необратимые, которые идут до конца в одном направлении, и обратимые, которые идут в двух противоположных направлениях:
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
2SO2 + O2 ↔ 2SO3.
Необратимыми являются реакции, в результате которых образуется газ, осадок или слабый электролит.
По признаку изменения степени окисления реакции делят на окислительно-восстановительные, которые протекают с изменением степени окисления атомов, и не окислительно-восстановительные, которые протекают без изменения степени окисления атомов:
2ZnS + 3O2 = 2ZnO + 2SO2
Na2O + CO2 = Na2CO3.
Следует помнить, что большинство органических реакций идут с изменением степени окисления атомов. В неорганических реакциях первый признак окислительно-восстановительной реакции – это участие в ней простого вещества, потому что степень окисления простых веществ равна нулю. Поэтому данный элемент будет либо повышать, либо понижать свою степень окисления. Так, в реакции окисления сульфида цинка участвует простое вещество – кислород. То есть в неорганических реакциях, реакции замещения также являются окислительно-восстановительными.
По участию в реакции катализатора реакции делят на каталитические, протекающие с участием катализатора, и некаталитические, которые не требуют применения катализатора. Большинство органических реакций идут только в присутствии катализатора:
ZnCl2 + 2AgNO3 = 2AgCl↓ + Zn(NO3)2
3H2 + N2 = 2NH3.
По наличию раздела фаз реагирующих веществ реакции делят на гомогенные, в которых реагирующие вещества находятся в одном агрегатном состоянии (жидком или газообразном), а также на гетерогенные, в которых реагирующие вещества находятся в разных агрегатных состояниях (или в твёрдом состоянии):
2KOH (р-р) + H2SO4 (р-р) = K2SO4 (р-р) + 2H2O (ж)
CuO (т) + H2 (г) = Cu (т) + H2O (ж).
Большинство реакций можно одновременно классифицировать по различным признакам:
2SO2
(г) + O2
(г)  2SO3
(г) + Q.
2SO3
(г) + Q.
Так реакция получения оксида серы (VI) из оксида серы (IV) является одновременно реакцией соединения, обратимой, окислительно-восстановительной, экзотермической, гомогенной и каталитической.
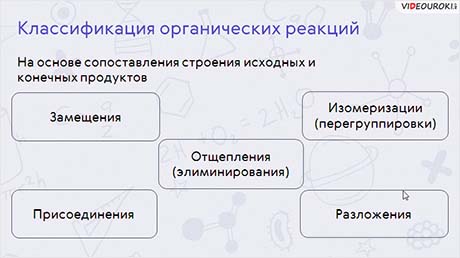
Органические реакции также можно классифицировать по различным признакам. На основе сопоставления строения исходных и конечных продуктов реакции делят на реакции замещения, присоединения, отщепления (элиминирования), изомеризации (перегруппировки), разложения.
В реакциях замещения атом или группа атомов в молекуле замещается на другой атом или группу атомов:
СH3 – CH3
+ Cl2  CH3
– CH2Cl + HCl.
CH3
– CH2Cl + HCl.
В реакциях присоединения молекулы органических веществ соединяются в новую молекулу, при чём образуется только один продукт реакции. Присоединение водорода – это реакция гидрирования, присоединение галогена – галогенирование, присоединение воды – гидратация, присоединение галогеноводорода – гидрогалогенирование:
HC ≡ CH + H2  H2C
= CH2
H2C
= CH2
CH3 – CH = CH2 + Br2 → CH3 – CHBr – CH2Br
H2C = CH2 + H2O
 H3C
– CH2OH
H3C
– CH2OH
HC ≡ C – CH3 + HCl → H2C = CCl – CH3.
К реакциям присоединения относятся также реакции полимеризации:
n(H2C = CH – CH = CH2)
 (-CH2
– CH = CH – CH2-)n.
(-CH2
– CH = CH – CH2-)n.
В реакциях отщепления происходит отрыв атомов или групп атомов от исходного вещества, но углеродный скелет при этом сохраняется:
H3C – CH2 – CH2Br
+ KOH  H3C
– CH = CH2 + KBr + H2O
H3C
– CH = CH2 + KBr + H2O
H3C – CH2OH  H2C
= CH2 + H2O
H2C
= CH2 + H2O
H3C – CH3  H2C
= CH2 + H2↑.
H2C
= CH2 + H2↑.
В реакциях изомеризации исходное вещество и продукт реакции являются изомерами. При этом углеродный скелет может изменяться:
H3C
– CH2
– CH2
– CH3  H3C
– CH – CH2
– CH3
H3C
– CH – CH2
– CH3
|
CH3
В результате реакций разложения из одного сложного вещества образуются несколько простых или сложных веществ. К органическим реакциям разложения относится крекинг, при котором происходит разрыв углерод-углеродной связи:
H3C – CH2 – CH2
– CH3  H3C
– CH3 + H2C = CH2.
H3C
– CH3 + H2C = CH2.
Если реакции разложения идут при высокой температуре, то они называются ещё пиролизом:
CH4  C
+ 2H2↑.
C
+ 2H2↑.
Органические вещества также вступают в окислительно-восстановительные реакции. При этом степени окисления изменяются у атомов углерода. Считается, что вещество окисляется, если теряет атом водорода и приобретает атомы кислорода. Кислородсодержащий окислитель обозначается символом [O]:
СH3
– CH2OH + CuO  CH3
– C = O + Сu + H2O.
CH3
– C = O + Сu + H2O.
|
H
Если вещество восстанавливается, то оно приобретает атомы водорода и теряет атомы кислорода. Восстановитель часто обозначается символом [H]:
C6H5NO2  C6H5NH2
C6H5NH2
В зависимости от разрыва ковалентной связи органические реакции делят на радикальные и ионные. А ионные реакции бывают электрофильные и нуклеофильные. При гомолитическом разрыве связи образуются свободные радикалы, так как частицы, которые имеют неспаренный электрон.
При гетеролитическом разрыве связи общая электронная пара остаётся у одного атома и образуется катион и анион.
В электрофильных реакциях электрофилы («любящие электроны») имеют свободную орбиталь:
H2C = CH2 + HCl → H3C – CH2Cl (H+ электрофил).
В нуклеофильных реакциях нуклеофилы («любящие ядро») имеют неподелённую пару электронов на внешнем уровне:
H2C = O + H – CN → H2C – OH
|
CN
CN – нуклеофил.
Решим задачи. Нужно рассчитать объём (н. у.) метана, сгоревшего в кислороде, в соответствии с термохимическим уравнением:
CH4 (г) + 2O2 (г) = CO2 (г) + H2O (г) + 803 кДж, если выделилось 40,15 кДж теплоты.
1 моль – 22,4 л
22,4 л – 803 кДж
х л – 40,15 кДж
х = 22,4 · 40,15 / 803 = 1,12 л.
При сгорании угля с образованием углекислого газа выделяется 394 кДж теплоты. Рассчитаем количество теплоты, которое выделится при получении оксида углерода (IV) объёмом 4,48 л (н. у.).
С (т) + О2 (г) = СО2 (г) + 394 кДж
22,4 л – 394 кДж
4,48 л – х кДж, х = 4,48 · 394 / 22,4 = 78,8 кДж.

 Получите свидетельство
Получите свидетельство Вход
Вход




 780
780

