Атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса – металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом, причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.

Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в двадцатом столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет своё значение до сих пор.

Впервые понятие «валентность» как соединительной силы ввёл Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность – это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда предвнешних уровнях атомов могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
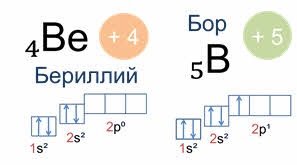
Рассмотрим эс-, пэ-, дэ-, эф - семейства химических элементов Периодической системы.

У эс и пэ элементов валентные электроны расположены на эс и пэ подуровнях внешнего энергетического уровня.

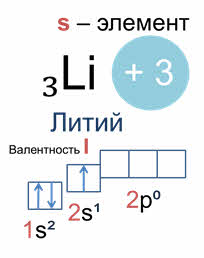
Например, литий, у которого заряд ядра плюс три, три электрона, электронная формула: один эс два два эс один; это эс элемент, атом имеет один неспаренный эс электрон, значит валентность лития один.
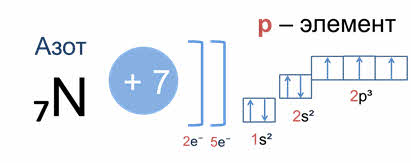
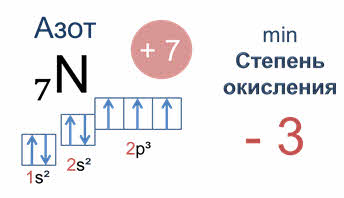
Рассмотрим другой пример, азот. Заряд его атома плюс семь, у него семь электронов. Электронная формула один эс два два эс два два пэ три; это пэ элемент. Соответственно, азот имеет пять валентных электронов – два спаренных эс электрона и три неспаренных пэ электрона.
У дэ элементов валентные электроны находятся на эс подуровне последнего энергетического уровня и дэ подуровне предвнешнего энергического уровня.

Например, у атома титана заряд ядра плюс двадцать два, соответственно столько же электронов двадцать два. Электронная формула атома титана: один эс два два эс два два пэ шесть три эс два три пэ шесть четыре эс два три дэ два, это дэ элемент. Титан имеет четыре валентных электронов, два спаренных эс электронов и два неспаренных дэ электронов.
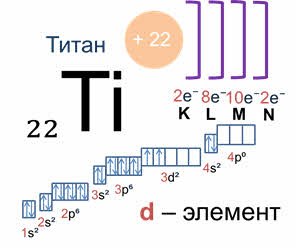
У эф элементов валентные электроны располагаются на эс подуровне последнего энергетического уровня и дэ подуровне предпоследнего энергетического уровня и эф подуровень, третьего с края энергетического уровня.
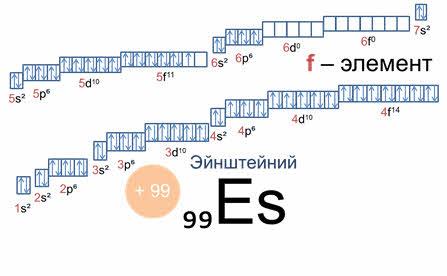
Например, у атома эйнштейния заряд ядра плюс девяноста девять, столько же у него и электронов. Электронная формула его внешних и предвнешних слоёв, заполняющихся последними, пять дэ десять шесть пэ шесть семь эс два пять эф одиннадцать; это эф элемент. Эйнштейний имеет тринадцать валентных электронов, двенадцать спаренных и один неспаренный на пять эф подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося учёного двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне.
Количеством этих неспаренных электронов и определяется валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.

Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.

Например, заряд ядра атома фосфора плюс пятнадцать, число электронов пятнадцать, электронная формула атома фосфора один эс два, два эс два, два пэ шесть, три эс два, три пэ три. В основном состоянии атом фосфора, который относится к пэ элементам, на внешнем уровне содержит одну пару спаренных электронов и три неспаренных электрона. Поэтому, он проявляет валентность три, так как у него три неспаренных пэ электрона. И валентность четыре, так как атом фосфора — это атом-донор, который может предоставить пару электронов для образования химической связи.
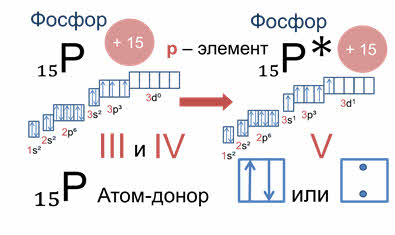
При имеющихся вакантных орбиталях на три дэ подуровне и паре спаренных электронов на три эс подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется пять неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора – пять.
Поэтому если у элементов на внешнем энергетическом уровне есть неспаренные электроны, они являются активными элементами или реакционноспособными, а если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят главную восьмую группу химических элементов Периодической системе. Их так и называют благородные или инертные (малоактивные) химические элементы, так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Эс, дэ, эф элементы – это металлические элементы кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем три; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем четыре.
Пэ элементы могут быть металлические и неметаллические.
Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все пэ элементы выше диагонали – неметаллические, ниже – металлические. По строению элементы, у которых на внешнем энергетическом уровне три или четыре электрона, считаются переходными элементами; многие дэ элементы – металлические с переходными свойствами.

У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления – это условный заряд атома – положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
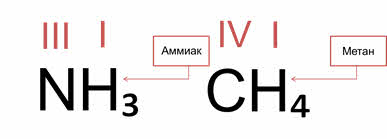
Если в соединении атом не проявляет валентность как донор, то степень окисления численно совпадает с валентностью. Например, в молекуле аммиака валентность азота равна трём и степень окисления равна тоже трём только с минусом.

И наоборот, если в соединении атом проявляет валентность как донор, то степень окисления численно не совпадает с валентностью. У катиона аммония атом азота проявляет валентность четыре, а степень окисления минус три.

Степень окисления может быть минимальной, промежуточной и максимальной.
Минимальная степень окисления для неметаллических элементов определяется числом валентных мест в незавершённом энергетическом уровне. У атома углерода она равна минус четыре, так как до устойчивости внешнего энергетического уровня атома углерода (до восьми электронов) число валентных мест – четыре.
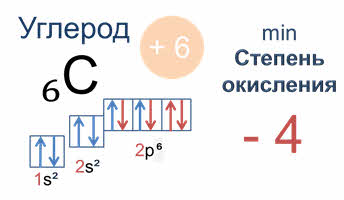
Соответственно, у атома азота минимальная степень окисления минус три, у кислорода – минус два.

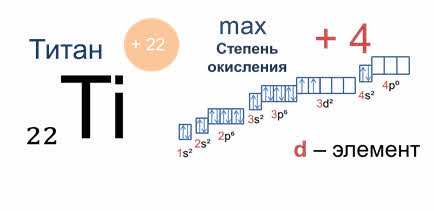
Максимальная степень окисления определяется суммой эс и пэ электронов на внешних энергетических уровнях, а для дэ элементов – суммой эс и дэ электронов.
Например, атом титана – это дэ элемент, металлический. На внешнем электронном слое четыре эс два, три дэ два у него находится четыре электрона. Значит, максимальная степень окисления титана плюс четыре.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
Определим степень окисления в бинарных соединениях на примере оксидов азота. Более электроотрицательным элементом, к которому смещаются электроны во всех оксидах, является кислород. Минимальная степень окисления кислорода равно минус двум, а молекула всегда электронейтральна. Следовательно, произведение степени окисления электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов. Таким образом, определяется валентность в соединениях, состоящих из двух элементов, то есть бинарных.

В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за икс. Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине. Также степень окисления в таких соединениях можно находить вот по такой схеме.

В простых веществах с неполярной ковалентной связью степень окисления равна нулю. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.

Таким образом, валентные возможности атомов определяются количеством неспаренных электронов в основном и возбуждённом состоянии, наличием неподелённых пар электронов, числом пустых орбиталей. Степень окисления и валентность это не одно и тоже понятие.

 Получите свидетельство
Получите свидетельство Вход
Вход





 4321
4321

